(разработана специальной комиссией ВОЗ в 1980 г.):
• Новое обозначение:
1) IFN-α; 2) IFN-β; 3) IFN-γ.
• Старое обозначение:
1) тип I (лейкоцитарный), pH 2,0 – стабильный, индуцируемый чужеродными клетками;
2) тип II (фибробластный), pH 2,0 – стабильный;
3) тип III (иммунный), pH 2,0 – лабильный, индуцируемый антигенами и митогенами.
По своей химической природе интерфероны являются гликопротеидами. Каждый из трех типов интерферонов (α, β, γ) разделяют на подтипы. Например, тип (семейство) α-интерферона включает около 20 подтипов, различающихся по биологическим свойствам и структуре. Среди них обнаружены и такие подтипы, которые утрачивают свою активность при рН 2,0, т. е. кислотолабильные. Множественность и структурная гетерогенность интерферонов, очевидно, отражают их функциональную гетерогенность, а также способность синтезироваться под влиянием различных индукторов. Молекулярная масса интерферонов варьирует от 17 до 45 кД у α– и β-интерферонов и от 20 до 80 кД у γ-интерферона; γ-интерферон продуцируют Т-лимфоциты, натуральные, или природные, киллеры, активированные макрофаги. В свою очередь он стимулирует образование молекул МНС класса II, является кофактором дифференцировки и активации В-лимфоцитов и антагонистом действия на них интерлейкина-4. Гены, контролирующие синтез интерферонов у человека, локализованы на 2, 5 и 9-й хромосомах.
В соответствии с гипотезой об индукции интерферона предполагается, что в клетках его синтез блокирован репрессором. При контакте клетки с индуктором, например вирусом, репрессор связывается, что приводит к активации оперона, контролирующего образование интерферона. Затем происходит транскрипция мРНК для интерферона и ее трансляция. Оперон для α-интерферона содержит до 12 структурных генов. Противовирусное действие интерферонов проявляется в их способности подавлять внутриклеточное размножение широкого круга ДНК– и РНК-вирусов. Интерферон не взаимодействует непосредственно с вирусом, он не препятствует адсорбции вируса на клетке и его проникновению в клетку. Антивирусное действие интерферонов не связано с синтезом какого-то нового белка, а проявляется в повышении активности ряда ключевых ферментов клеточного обмена веществ (рис. 62). Один из возможных механизмов антивирусной активности интерферона заключается в том, что он увеличивает продукцию протеинкиназы, которая фосфорилирует один из факторов инициации трансляции и ингибирует синтез белка. Другой механизм сводится к тому, что под влиянием интерферона накапливается олигоаденилатсинтетаза, приводящая к образованию 2,5-олигоадениловой кислоты. Последняя активирует клеточную эндонуклеазу, которая разрушает молекулы РНК, в том числе и мРНК. Так или иначе, под влиянием интерферона блокируется синтез вирусных макромолекул. Повидимому, в зависимости от типа рецепторов клетки, особенностей самих клеток и типов интерферонов, последние реализуют свое воздействие через активацию синтеза разных ферментных систем. Индукция синтеза интерферона происходит под воздействием самых различных факторов: ДНК– и РНК-содержащих вирусов, бактерий, риккетсий, простейших, различных микробных антигенов, а также различных синтетических соединений. Наиболее характерные черты биологического действия интерферона следующие:
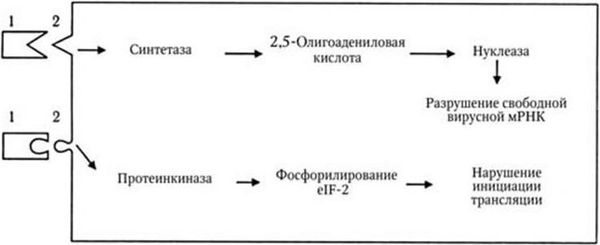
Рис. 62. Механизм действия интерферона (по А. Г. Букринской, 1986):
1 – интерферон; 2 – клеточный рецептор
1) универсальность – интерферон активен против широкого круга вирусов;
2) выраженная тканевая специфичность – он активен в гомологичных системах и практически не активен в гетерогенных тканях (поэтому для лечения человека можно использовать только интерферон человеческого происхождения), биологическая активность интерферона определяется его полипептидом, а тканеспецифичность – углеводным компонентом;
3) наличие эффекта последействия – даже после отмывания интерферона в клетках длительное время сохраняется способность подавлять размножение вирусов;
4) отсутствие какого-либо токсического эффекта – обработка интерфероном клеток не нарушает их нормальной жизнедеятельности;
5) высокая эффективность действия – даже небольшое количество интерферона (несколько десятков молекул) обладает противовирусной активностью.
Интерфероны обладают не только противовирусным, но и противобактериальным (более сильным против грамположительных бактерий и хламидий и менее сильным против других грамотрицательных бактерий) и противоопухолевым действием. Такое их действие связано прежде всего с тем, что интерфероны – мощные иммуномодуляторы. Они стимулируют гуморальный иммунитет, усиливая антителообразование, восстанавливают соотношение T-хелперы/T-супрессоры, уменьшают степень иммунодепрессии, стимулируют фагоцитоз, активность цитокинов, всех киллерных клеток и T-цитотоксических лимфоцитов и т. д. В основе такой широкой активности интерферонов лежит их способность включаться в различные метаболические процессы и регулировать их, поэтому систему интерферонов следует рассматривать как неотъемлемую составную часть общей иммунной системы. Синтез молекул интерферонов – первый ответ на получение клетками неспецифического сигнала о появлении чужеродных антигенов. Включаясь в регуляцию метаболических процессов в клетках, тканях и органах, интерфероны обеспечивают поддержание гомеостаза на всех уровнях организации от клетки до целостного организма. В связи с этим для стимуляции синтеза эндогенных интерферонов и усиления их иммуномодулирующего действия в практику лечения и профилактики вирусных и других инфекционных заболеваний, особенно таких, при которых возбудитель оказывает негативное действие на систему интерферонов, помимо собственно интерферонов все шире внедряются различные синтетические стимуляторы интерферонообразования.
Два таких препарата успешно используются: амиксин и арбидол. Амиксин – первый пероральный синтетический низкомолекулярный индуктор эндогенного интерферона. Его применяют по специальным схемам для профилактики и лечения гриппа и других острых респираторных вирусных инфекций (ОРВИ), герпетических, цитомегаловирусных и нейровирусных заболеваний, энтеральных (A, E) и парентеральных вирусных гепатитов (B, C, D, E, G, TTV) и хламидиозов. Амиксин нетоксичен и хорошо совместим с антибиотиками и средствами традиционного лечения вирусных и бактериальных болезней. Арбидол помимо интерферониндуцирующего и иммуномодулирующего обладает и прямым антивирусным действием. Он применяется для профилактики и лечения гриппа и ОРВИ у взрослых и детей по специальным схемам.
Киллерные клетки
Помимо систем макрофагов, комплемента и интерферонов, в обеспечении видового иммунитета исключительно важная роль принадлежит Т-цитотоксическим лимфоцитам, а также главной системе гистосовместимости (см. соответствующие разделы).
Роль Т-цитотоксических лимфоцитов, или Т-киллеров, заключается в том, что они по представлению антигенов главной системы гистосовместимости класса I распознают любые чужеродные антигены, например вирусные, а также собственные мутантные клетки, например раковые, атакуют и уничтожают их.
Кроме Т-цитотоксических лимфоцитов, киллерными функциями обладают обнаруженные в 1976 г. в лимфоидной ткани природные, или естественные, киллеры – клетки NK (англ. natural killer – природный убийца). Они найдены в лимфоидной ткани животных всех изученных видов, кроме кошек. Хотя NK относятся к лимфоцитам, они не обладают свойствами ни зрелых В-, ни зрелых Т-лимфоцитов и имеют свойственные только им маркеры; происходят они из клеток-предшественников костного мозга. В отличие от Т-цитотоксических лимфоцитов киллерная активность NK не зависит от представления им чужеродных антигенов молекулами МНС класса I. NK способны распознавать и лизировать различные варианты опухолевых клеток. В этом заключается важная роль их в поддержании генетического гомеостаза.
Цитотоксическим фактором природных киллеров является особый белок, который по физико-химическим и иммунологическим свойствам напоминает белок перфорин из цитолитических гранул. Этот белок в присутствии ионов Ca способен быстро полимеризоваться. Образующиеся субъединицы белка встраиваются в мембрану клетки, формируя в ней канал с малым диаметром. Через канал в клетку проникает вода, клетка разбухает и лизируется.
ЗАКЛЮЧЕНИЕ К ГЛАВАМ 21 – 27
Таким образом, если естественная резистентность организма во многом определяется состоянием его различных анатомо-физиологических механизмов, перечисленных выше, то видовой иммунитет – функция высокоспециализированных иммунных систем. В результате хорошо координированного взаимодействия систем макрофагов, комплемента, интерферонов, главной системы гистосовместимости, Т-цитотоксических лимфоцитов и природных киллеров еще до приобретения специфического иммунитета обеспечивается своевременное распознавание и уничтожение всех генетически чужеродных веществ и существ (микроорганизмов и мутантных клеток), благодаря чему и сохраняется структурная и функциональная целостность организма. Вместе с тем иммунные системы служат основой для формирования приобретенного (специфического) иммунитета, и на их уровне видовой и приобретенный иммунитет стыкуются, образуя единую и наиболее эффективную систему самозащиты организма.
Глава 28
Основные биологические механизмы самозащиты генома клетки
Иммунитет существует не только на уровне целостного организма, но и на уровне клетки. Здесь он направлен на защиту самого ценного, что имеется в клетке, – ее генома и опосредуется самим геномом.
Одним из самых удивительных свойств генетической системы является ее способность к самозащите (иммунитету), реализуемая с помощью специальных биологических механизмов, обеспечивающих необходимую для существования и эволюции живой материи стабильность генетической информации и высокую надежность ее функционирования.
Действие этих механизмов проявляется как в особых реакциях, посредством которых осуществляется самоисправление различных нарушений в структуре ДНК (приводящих либо к извращению смысла генетической информации, либо к структурным повреждениям, имеющим летальные последствия), так и в реакциях, ведущих к исключению возможности функционирования в клетке чужеродного генома. В соответствии с этим, известные биологические механизмы самозащиты генома клетки можно разбить на следующие основные группы:
1) механизмы ревизии, позволяющие исключить из вновь синтезируемой ДНК ошибочно включенные нуклеотиды; благодаря этому механизму возможность включения ошибочного нуклеотида сводится к минимуму;
2) механизмы супрессии, или исправления нарушенного смысла генетического кода;
3) механизмы репараций, или самоисправлений структурных повреждений в ДНК;
4) механизмы модификации и ограничения (рестрикции), контролируемые хозяином;
5) механизмы подавления репродукции в клетке чужеродного генома;
6) механизмы подавления выражения информации чужеродного генома, интегрированного в геном клетки-хозяина.
Механизмы ревизии, или самокоррекции, осуществляются ДНК-полимеразой. Она способна устранять свои собственные ошибки, которые могут возникать в процессе репликации ДНК, обнаруживать и удалять неправильные пары и замещать их правильными. Благодаря такой саморевизии и самокоррекции обеспечивается необычайно высокая точность копирования при репликации ДНК. В среднем на каждые 1 · 10 комплементарных пар, образующихся при воспроизведении генома млекопитающего, состоящего из 3 · 10 пар оснований, происходит одна ошибка.
Супрессии, или супрессорные мутации, – это мутации, ведущие к восстановлению исходного фенотипа мутантной клетки. В основе супрессии лежат так называемые обратные мутации: восстановление исходного фенотипа происходит не в результате восстановления первоначального состояния самого мутантного гена, а вследствие дополнительных мутаций в том же или в других генах, которые и приводят к восстановлению исходного фенотипа.
Репарация ДНК основана на том, что генетическая информация в ДНК продублирована двумя копиями – по одной копии в каждой из двух цепей молекулы ДНК. Благодаря этому случайное повреждение в одной из цепей может быть удалено репарационными ферментами, и данный участок цепи заново синтезирован в своем нормальном виде за счет информации, которая содержится в неповрежденной цепи. Процессы репарации осуществляются с помощью особых наборов ферментов: ДНКполимераз, ДНК-лигаз или ДНК-гликозилаз.
Кроме явлений саморепликации, репарации и процессов, с помощью которых устраняются различные нарушения в структуре самого генома или исправляются нарушения информации, для его самозащиты клетка использует и другие биологические механизмы, направленные главным образом на исключение возможности конкурентного функционирования проникающего в него чужеродного генома. С помощью этих механизмов осуществляется либо избирательное разрушение чужеродного генома и таким образом исключается возможность его интеграции в геном клеткихозяина, либо предотвращается его репродукция в клетке, либо подавляется выражение содержащейся в нем информации, даже если он интегрировался в геном клетки-хозяина. К таким механизмам относятся, в частности, механизмы ограничения и модификации и система интерферонов.
Механизмы модификации и ограничения, контролируемые клеткой-хозяином, описаны у различных видов бактерий. Они связаны с активностью двух взаимодополняющих ферментных систем, одна из которых осуществляет специфическую модификацию "своей" ДНК (благодаря чему она и распознается ферментами ограничения как "своя" ДНК), а другая – система ограничения (рестрикции) – разрушает неприемлемую ДНК, если она не прошла соответствующей модификации, т. е. является "чужой" и должна быть разрушена.
О существовании в клетке специальных биологических систем, подавляющих репродукцию чужеродного генома, свидетельствует наличие белков-интерферонов. Хотя прямых доказательств существования систем, подавляющих выражение информации чужеродного генома, интегрированного в геном клетки-хозяина, еще не представлено, однако существует целый ряд косвенных данных, которые делают такое предположение весьма правдоподобным. Поскольку состояние лизогении (внедрение фагового генома в хромосому бактериальной клетки) или вирогении (внедрение вирусного генома в геном животной клетки) далеко не всегда проявляется фенотипически (вирус иммунодефицита человека может находиться в неактивном состоянии в течение ряда месяцев или лет), то правомерно предположить, что выражение чужеродной генетической информации каким-то образом временно или постоянно блокируется. Вместе с тем лизогения создает прочный иммунитет против суперинфекции данным фагом, т. е. обеспечивает специфический иммунитет против него. Таким же образом привнесенная в бактериальную клетку плазмида обеспечивает ей защиту против повторного заражения данной плазмидой. Так у бактерий возникает своеобразный иммунитет против чужеродных геномов.
Глава 29
Приобретенный иммунитет. Антигены
Приобретенный иммунитет отличается от видового следующими особенностями. Во-первых, он не передается по наследству. По наследству передается лишь информация об органе иммунитета, а сам иммунитет формируется в процессе индивидуальной жизни в результате взаимодействия с соответствующими возбудителями или их антигенами.
Во-вторых, приобретенный иммунитет является строго специфическим, т. е. всегда направлен против конкретного возбудителя или антигена. Один и тот же организм в течение своей жизни может приобретать невосприимчивость ко многим болезням, но в каждом случае формирование иммунитета связано с появлением специфических эффекторов против данного возбудителя.
Иммунологическая функция, как и всякая другая функция организма, связана с деятельностью определенной специализированной системы клеток и тканей. Органом иммунитета является лимфоидная система. Особенность ее состоит в том, что она существует не в виде единого дискретного анатомического образования, а расселена по всему телу, чтобы во всех его участках осуществлять свою защитную функцию. Кроме того, иммунной системе присущи еще две особенности:
1) ее клетки постоянно рециркулируют через лимфу и кровоток по всему организму, осуществляя иммунологический надзор;
2) она обладает способностью отвечать уникальными реакциями на попадание в организм антигена.
Совокупность всех лимфоидных органов и тканей организма (тимус, селезенка, лимфатические узлы, пейеровы бляшки и другие лимфоидные скопления, лимфоциты костного мозга и периферической крови) представляет единый орган иммунитета. Общий вес лимфоидной системы у человека около 1,5 – 2 кг, количество лимфоидных клеток составляет 10.
Приобретенный иммунитет обеспечивается теми же самыми иммунными системами, которые осуществляют видовой иммунитет, но их активность и целенаправленность действия во много раз усиливаются благодаря синтезу специфических антител. Формирование приобретенного специфического иммунитета происходит благодаря кооперативному взаимодействию макрофагов (и других антигенпредставляющих клеток), В– и Т-лимфоцитов и при активном участии всех остальных иммунных систем.
Формы приобретенного иммунитета
В зависимости от механизма образования приобретенный иммунитет подразделяется на искусственный и естественный, а каждый из них в свою очередь – на активный и пассивный. Естественный активный иммунитет возникает вследствие перенесения заболевания в той или иной форме, в том числе легкой и скрытой. Такой иммунитет называется также постинфекционным. Естественный пассивный иммунитет создается в результате передачи ребенку от матери антител через плаценту и грудное молоко. Организм ребенка в этом случае сам не участвует в активной выработке антител. Искусственный активный иммунитет – иммунитет, образующийся в результате прививок вакцинами, т. е. поствакцинальный. Искусственный пассивный иммунитет обусловлен введением иммунных сывороток или препаратов гамма-глобулина, содержащих соответствующие антитела.
Активно приобретенный иммунитет, особенно постинфекционный, устанавливается спустя некоторое время после заболевания или прививки (1 – 2 нед.), сохраняется долго – годами, десятилетиями, иногда пожизненно (корь, оспа, туляремия). Пассивный иммунитет создается очень быстро, сразу после введения иммунной сыворотки, но зато сохраняется очень недолго (несколько недель) и снижается по мере исчезновения введенных в организм антител. Продолжительность естественного пассивного иммунитета новорожденных также невелика: к 6 мес. он обычно исчезает, и дети становятся восприимчивы ко многим болезням (корь, дифтерия, скарлатина и др.).