Антигенные свойства у искусственно получаемых полиаминокислот возникают только на уровне сополимеров, т. е. когда появляется возможность определенных сочетаний аминокислот в таких структурах. Последовательность расположения аминокислот в каждой природной полипептидной цепи уникальна и генетически детерминирована. Поэтому возможность появления необычных для данного организма сочетаний аминокислот в составе полиаминокислот возникает лишь в том случае, если для их синтеза берутся разные аминокислоты. При этом опять-таки антигенность и специфичность полиаминокислот в значительной степени определяются остатками ароматических аминокислот – тирозина, фенилаланина, триптофана, содержащих в себе жесткое кольцо. По мнению Ф. Гауровитца, жесткость структуры детерминантных групп является обязательным условием антигенности молекулы. Детерминантная группа должна находиться на поверхности молекулы и быть доступной для систем иммунного ответа. Неспособность жирных кислот служить антигенными детерминантами Ф. Гауровитц объясняет тем, что их молекулы содержат длинные цепи парафиновых углеводородов, лишенных жесткой структуры, в связи с чем взаимное расположение химических групп, образующих молекулу жирной кислоты, в пространстве постоянно меняется.
Детерминантные группы нативных белков возникают из различных аминокислотных остатков, представляющих поверхностно расположенные группы определенной конформации. Важную роль в их образовании, очевидно, играют указанные выше аминокислоты. Вместе с тем и общая конформация белковой молекулы, т. е. ее вторичная и третичная структура, также определяет иммунологическую специфичность. Денатурирование белка меняет его антигенную специфичность. В свете этого становится понятным, почему присоединение различных химических группировок к белку приводит к изменению его антигенной специфичности. Гаптен, присоединенный к молекуле белка, изменяет ее конформацию и придает ей новую специфичность. У белка РНКазы, аминокислотная последовательность которой известна, детерминантные группы образованы аминокислотными остатками 39 – 52 и 105 – 124. Окисление или восстановление РНКазы приводит к изменению ее антигенной специфичности. Все три формы молекулы РНКазы – нативная, восстановленная и окисленная – обладают антигенной специфичностью и индуцируют образование различных по специфичности антител.
Таким образом, антигенность белков является функцией их чужеродности, а ее специфичность зависит от аминокислотной последовательности, которая определяет все свойства белка; от вторичной, третичной и четвертичной структуры, т. е. от общей конформации белковой молекулы; от поверхностно расположенных детерминантных групп и концевых аминокислотных остатков. Количество детерминантных групп в белковой молекуле возрастает пропорционально ее молекулярной массе. Например, в молекуле дифтерийного токсина (м. м. 61 кД) обнаружено около 8, тиреоглобулина (м. м. 650 кД) – 40, а гемоцианина (м. м. 6,5 МД) – более 230 детерминантных групп.
Антигенное строение микробной клетки
Для медицинской микробиологии наибольший интерес представляют антигенные свойства бактерий, токсинов и вирусов. Результаты их изучения используются в практике получения высокоэффективных иммуногенных препаратов, а также для совершенствования методов идентификации возбудителей болезней. Обладая сложным химическим строением, бактериальная клетка представляет собой целый комплекс антигенов. Антигенными свойствами обладают жгутики, капсула, клеточная стенка, цитоплазматическая мембрана, рибосомы и другие компоненты цитоплазмы, а также различные продукты белковой природы, выделяемые бактериями во внешнюю среду, в том числе токсины и ферменты. В связи с этим различают следующие основные виды микробных антигенов: соматические, или О-антигены; жгутиковые, или Н-антигены; поверхностные, или капсульные К-антигены (нем. Kapsel – капсула).
Символы, обозначающие названия жгутиковых и соматических антигенов, были предложены в связи со следующим феноменом. Протей, обладающий жгутиками, дает на плотной среде характерный рост в виде роения, напоминающий налет на холодном стекле, образующийся при дыхании на него. Протей, лишенный жгутиков, растет иначе. Поэтому жгутиковые антигены стали обозначать символом "Н" (нем. Hauch – дыхание), соматические антигены – "О" (нем. ohne Hauch – без дыхания).
Соматические антигены в большинстве случаев термостабильны, выдерживают нагревание до 80 – 100 °C. Они представляют собой сложные полисахаридолипидопротеидные комплексы. Антигенную специфичность грамотрицательных бактерий, например сальмонелл, определяют полисахариды, содержащиеся в ЛПС клеточной стенки. Помимо общего гетерополисахарида, в состав которого входят гептозофосфат и N-ацетилглюкозамин, сальмонеллы имеют специфические полисахариды, в молекулах которых концевые дезоксисахара (тивелоза, паратоза, колитоза, абеквоза и др.) выполняют функцию соответствующих антигенных детерминант. Род Salmonella по О-антигенам подразделяется на ряд групп. Каждая группа характеризуется наличием общего группового антигена, специфичность которого определяется указанными дезоксисахарами. Например, в группе А – паратозой, в группе О – колитозой и т. д.
Жгутиковые антигены, имеющие белковую природу, как правило, термолабильны (разрушаются при температуре 60 – 80 °C). Они также отличаются высокой специфичностью. Изучение жгутиковых антигенов позволяет выделить, например в группах сальмонелл, различные серологические варианты. На основании особенностей строения О– и Н-антигенов род Salmonellа подразделяется более чем на 2200 сероваров.
Капсульный антиген пневмококков является чистым полисахаридом, он определяет специфичность, на основании которой пневмококки подразделяются более чем на 80 сероваров. Состав сахаров многих типов известен, и структура некоторых из них установлена. Например, у пневмококков третьего серовара полисахарид представлен полимером из повторяющихся единиц целлобиуроновой кислоты с молекулярной массой 276,5 кД. Целлобиуроновая кислота является дисахаридом D-глюкуроновой кислоты и D-глюкозы, связанных между собой b-1,4-гликозидной связью.
К-антиген располагается поверхностнее О-антигенов. Например, у E. coli, помимо О– и Н-антигенов выявлен ряд К-антигенов. По степени устойчивости к высокой температуре они подразделяются на L-, B– и А-антигены. У вирулентных штаммов S. typhi обнаружен относительно термолабильный поверхностный антиген, получивший название Vi-антигена.
Стрептококки обладают тремя разными по степени специфичности антигенами. У них имеются общий родовой нуклеопротеидный антиген (Р-антиген), групповой полисахаридный С-антиген и типоспецифические антигены. По С-антигену стрептококки подразделяются на 20 серологических групп (А, В, С, D, Е, F…V). В свою очередь стрептококки группы А по типоспецифическому белковому М-антигену дифференцируются на 100 сероваров.
Антигенные свойства присущи также микробным токсинам, ферментам и другим бактериальным белкам. Экзотоксины рассматриваются как внеклеточные антигены. У бактерий выделяют еще так называемые протективные антигены. Впервые они были найдены в экссудатах животных, больных сибирской язвой. Их можно получить при культивировании сибиреязвенных бацилл на животных тканях и специальных питательных средах, состоящих из аминокислот. Протективные антигены обладают весьма высокими предохраняющими свойствами и могут быть использованы в практике иммунизации против некоторых инфекционных болезней, в частности против сибирской язвы и чумы. Подобные антигены найдены у возбудителей коклюша, бруцеллеза, туляремии и у других микроорганизмов. Наконец, у бактерий выявлены также антигены, общие с антигенами тканей млекопитающих, так называемые перекрестно реагирующие антигены. Например, установлено наличие общих антигенов у эритроцитов человека, стафилококков, стрептококков, бактерий чумы, кишечной палочки, некоторых сальмонелл, шигелл, вирусов оспы, гриппа и других возбудителей инфекционных болезней. Если имеется сходство антигенной структуры хозяина и возбудителя, макроорганизм не способен вырабатывать иммунитет, и болезнь протекает более тяжело. Возможно, в отдельных случаях длительное носительство возбудителя и неэффективность вакцинации являются следствием общности антигенов микроба с антигенами тканей человека.
У некоторых бактерий обнаружены так называемые суперантигены. Ими являются, например, стафилококковые экзотоксины: энтеротоксины и токсин, вызывающий синдром токсического шока. Свое название суперантигенов такие белки получили потому, что они, связываясь отличным от других антигенов способом с рецепторами Т-лимфоцитов, активируют их. Т-лимфоциты (Т-хелперы) начинают быстро размножаться и секретировать избыточное количество интерлейкина-2, который и вызывает отравление. В свою очередь избыточное количество Т-лимфоцитов может привести к различным аутоиммунным заболеваниям и подавлению самmой иммунной системы.
Глава 30 Главная система гистосовместимости
В зависимости от степени генетического родства организмов различают ткани и, соответственно, трансплантаты сингенные, аллогенные и ксеногенные. Сингенные трансплантаты (изотрансплантаты) приживаются хорошо, так как иммунная система реципиента не распознает их как чужеродные. На пересадку аллогенной, отличающейся по изоантигенам, а тем более ксеногенной ткани индивидуумов разных видов организм отвечает трансплантационным иммунитетом, т. е. реакциями, направленными на отторжение генетически чужеродной ткани. Материальным субстратом несовместимости являются внутривидовые различия тканевых антигенов, т. е. изоантигены и их комбинации. Начало изучению изоантигенов положил К. Ландштейнер в 1901 г. Он описал изоантигены эритроцитов системы АВ0. Изоантигены эритроцитов человека изучены достаточно хорошо, их известно уже более 70.
Эритроцитарные изоантигены играют определенную роль в трансплантационном иммунитете, хотя значимость различных систем их в определении тканевой несовместимости неодинакова и антигенная дифференцировка тканей связана не только с ними. Существуют и другие системы изоантигенов ткани, в том числе и такие, которые главным образом ответственны за отторжение аллогенных трансплантатов. Они получили название трансплантационных антигенов, или антигенов гистосовместимости; гены, определяющие их синтез, называются Н-генами, или Н-локусами (англ. histocompatibility – тканевая совместимость). Трансплантационные антигены во многом определяют индивидуальную антигенную специфичность организма, в том числе и человека. Совокупность генов, определяющих синтез трансплантационных антигенов, получила название главной системы гистосовместимости, или кратко – системы МНС (англ. major histocompatibility complex). Общий план строения ее одинаков у всех млекопитающих. Он включает в себя несколько локусов, которые определяют синтез основных антигенов гистосовместимости, а также гены, контролирующие силу иммунного ответа, и некоторые другие.
У человека главная система гистосовместимости имеет второе название – система HLA (англ. human leucocyte antigens) в связи с тем, что контролируемые ею трансплантационные антигены HLA хорошо представлены на лейкоцитах. Гены системы МНС (HLA) у человека расположены на коротком плече хромосомы С6. В соответствии с решением Номенклатурной комиссии по лейкоцитарным антигенам (1985 г.) HLA-система включает в себя 7 генетических локусов, которые, помимо того что контролируют иммунный ответ на аллотрансплантаты, играют важнейшую роль в контроле клеточных взаимодействий, лежащих в основе иммунных реакций, а также синтезе некоторых компонентов системы комплемента. Эти локусы поделены на 3 класса.
К классу I относятся три локуса HLA – A, B и С. Они контролируют синтез антигенов (белков) МНС класса I: HLA-A включает 23 аллеля (нем. Allele – альтернативные варианты генов одного и того же локуса), определяющих синтез 23 антигенов класса I; HLA-B включает 49 аллелей, котoрые контролируют синтез 49 белков класса I; HLA-C включает 8 аллелей, контролирующих синтез 8 антигенов класса I.
К классу II относится область HLA-D, которая состоит из трех локусов: HLA-DR, HLA-DQ и HLA-DP. Эти гены контролируют синтез антигенов МНС класса II.
С областью HLA связаны также гены, контролирующие компоненты С2, С4А, С4В и Вf (фактор В пропердина) системы комплемента. Они обозначаются как белки класса III. Такое деление антигенов системы МНС на классы основано на различиях в их химической структуре и функциональных свойствах. Антигены класса I имеются на поверхности всех ядросодержащих клеток организма, но, по-видимому, в различном количестве.
Антигены класса II несут главным образом макрофаги и В-лимфоциты, в меньшем количестве они содержатся на некоторых активированных Т-лимфоцитах.
Антигены класса III (компоненты комплемента) встречаются только в крови, их нет на мембранах клеток. К системе МНС относятся и гены, контролирующие активность иммунной системы: гены Ir – силы иммунного ответа (англ. immune response) и гены Is – супрессии иммунного ответа (англ. immune suppress); они также сцеплены с областью HLA-D. Весь комплекс HLA состоит из 2 – 3 млн пар нуклеотидов.
Структура антигенов МНС класса I такова (рис. 63). Они представляют собой димерные гликопротеиды, которые состоят из тяжелой и легкой полипептидных цепей. Тяжелая цепь (45 кД) состоит из трех глобулярных внеклеточных (α1, α2, α3), гидрофобного трансмембранного и цитоплазматического доменов. К домену α1 с помощью N-гликозидной связи присоединяется короткая боковая углеводная цепочка. Домены α2 и α3 зафиксированы дисульфидными связями. С доменом α3 нековалентно связана легкая полипептидная цепь β-микроглобулин (11,6 кД), она кодируется геном, расположенным вне МНС. Детерминанты (эпитопы), распознаваемые антителами к антигенам класса I, расположены на внеклеточных доменах.
Антигены МНС класса II (Iα-антигены) состоят из двух пересекающихся полипептидных цепей: a (35 кД) и β (25 кД). Каждая цепь имеет два внеклеточных, гидрофобный трансмембранный и цитоплазматический домены. С помощью гидрофобных трансмембранных доменов полипептидные цепи "заякориваются" в мембране. В составе полипептидных цепей антигенов класса II и a-цепи антигенов класса I имеются константные домены (т. е. домены с постоянными аминокислотными последовательностями) и вариабельные (т. е. с вариабельными аминокислотными последовательностями) домены. Распознавание и связывание ими чужеродных антигенов, которые они затем представляют иммунокомпетентным клеткам, осуществляются особыми активными центрами, которые формируются за счет вариабельных доменов (один – от α-цепи, а другой – от β-цепи), соединенных на дне "щели" неспирализованной области, которая образуется сегментами обеих цепей. Антигены МНС класса I определяют индивидуальную антигенную специфичность, и они представляют любые чужеродные антигены Т-цитотоксическим лимфоцитам.
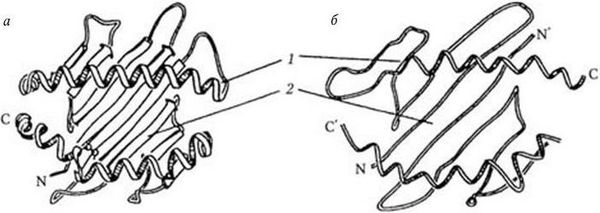
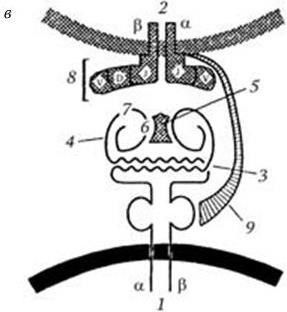
Рис. 63. Структура антигенсвязывающих участков молекул HLA класса I (а) и класса II (б) по Бьоркману (1987) и схема строения тримолекулярного комплекса (в), с дополнениями к схеме в обзоре Нельсон (1990):
а, б: 1 – альфа-спирали; 2 – платформа из восьми полос, образованная бета-складками дистальных доменов молекул HLA; в: 1 – антигенпредставляющая клетка; 2 – Т-лимфоцит; 3 – платформа антигенсвязывающего участка молекулы HLA класса II, образованная бета-складками ее дистальных доменов; 4 – альфа-спиральные структуры дистальных доменов молекулы HLA класса II, образующие боковые стенки углубления, в котором помещается антиген – 5; 6 – дезетоп; 7 – гистотоп; 8 – Т-клеточный рецептор; 9 – CD4-молекула (из обзора Сартаковой М. Л., Коненкова В. И., Успехи соврем. биол., 1997, т. 117, вып. 5, с. 568)
Назначение антигенов МНС класса II заключается в том, что они обеспечивают взаимодействие между макрофагами и В-лимфоцитами. Эти антигены необходимы на всех стадиях иммунологического процесса: на стадии представления антигена макрофагами Т-лимфоцитам, на стадии межклеточного иммунологического взаимодействия между макрофагами, Т– и В-лимфоцитами и на стадии дифференцировки иммунокомпетентных клеток. Антигены МНС класса II участвуют в формировании всех видов иммунного ответа: противомикробного, противоопухолевого, трансплантационного и др. На мембранах клеток-носителей антигены класса II располагаются независимо от антигенов класса I, рецепторных иммуноглобулинов и Fc-рецепторов. Количество антигенов класса II на мембранах фагоцитов возрастает при их активировании и в результате действия лимфокинов.
Структуры, с помощью которых белки МНС класса II и класса I связывают антигены, по уровню специфичности уступают только активным центрам антител.
Для обнаружения и типирования антигенов системы HLA вначале использовали метод агглютинации лейкоцитов, а сейчас используют в основном метод комплементзависимой цитотоксичности. С этой целью вначале лимфоидные клетки инкубируют с различными разведениями аллоиммунных сывороток, а затем с комплементом. Если искомый антиген присутствует на поверхности клетки, то произойдет ее лизис и гибель, опосредованная комплементом. Гибель клеток определяют либо биоскопически (по включению витального красителя), либо по выходу из предварительно меченных клеток изотопа.
С системой МНС связаны следующие иммунологические свойства:
1. Интенсивное отторжение трансплантатов тканей.
2. Стимуляция образования антител.
3. Стимуляция реакции в смешанной культуре лимфоцитов (стимуляция бласттрансформации).
4. Реакция "трансплантат против хозяина".
5. Клеточная реакция лимфолиза.
6. Контроль силы иммунного ответа (Ir-гены) и супрессия иммунного ответа (Is-гены).
7. Контроль синтеза некоторых компонентов системы комплемента (С2, С4А, С4В, В7).