Прыжок от одного состояния к другому может происходить в любом направлении, как вверх, так и вниз по энергетической лестнице. Если атом поглощает свет, то квант hv используется для того, чтобы передвинуть его на более высокий энергетический уровень (на следующую ступеньку лестницы). Если электрон затем падает на свое изначальное место, излучается ровно такая же энергия hv. Таинственная константа 36,456 × 10 в формуле Бальмера может быть свободно записана с помощью постоянной Планка, а это означало, что Бор мог рассчитать возможные энергетические уровни, "открытые" для одиночного электрона в атоме водорода. Кроме того, измеренная частота спектральных линий теперь могла толковаться как определение энергетической разницы между различными уровнями.
Водород получает объяснение
Обсудив свою работу с Резерфордом, в серии статей в 1913 году Бор опубликовал собственную теорию атома. Теория хорошо работала для водорода, и казалось, что она может быть развита дальше, чтобы объяснить также спектры более сложных атомов. В сентябре Бор посетил восемьдесят третью ежегодную встречу Британской ассоциации развития науки и представил свою работу аудитории, которая в основном состояла из самых именитых физиков того времени. В общем и целом его доклад восприняли хорошо, а сэр Джеймс Джинс назвал его изобретательным, убедительным и заставляющим задуматься. Дж. Дж. Томсон оказался в числе тех, кого доклад не убедил, однако именно благодаря этой встрече ученые, которые сочли аргументы недостаточными, хотя бы услышали о Боре и его работе над атомами.
Спустя тринадцать лет с отчаянного решения Планка ввести квант в теорию света Бор ввел квант в теорию атома. Однако потребовалось еще тринадцать лет, чтобы появилась настоящая квантовая теория. В то время прогресс шел болезненно медленно – нужно было делать шаг назад, чтобы потом продвигаться на два шага вперед, а иногда и два шага назад взамен на один шаг в правильном направлении. Атом Бора представлял собой настоящую мешанину. Он сочетал квантовые идеи с классическими, используя любую кажущуюся необходимой смесь, чтобы сметать куски и сделать модель работоспособной. Он "разрешал" существование гораздо большего количества спектральных линий, чем наблюдалось в излучении различных атомов, и приходилось вводить произвольные правила, чтобы некоторые переходы между различными энергетическими состояниями в атоме стали "запрещенными". Новые свойства атома – квантовые числа – назначались от случая к случаю, чтобы соответствовать наблюдениям, хотя не существовало должного теоретического обоснования того, зачем нужны были эти квантовые числа или почему некоторые из переходов оказывались запрещены. В процессе этого европейский мир потрясло начало Первой мировой войны, разразившейся на следующий год после того, как Бор представил свою первую модель атома.
Как и любая другая сфера жизни, наука после 1914 года уже не могла быть прежней. Из-за войны ученые больше не могли свободно переезжать из одной страны в другую. Начиная с Первой мировой войны некоторым ученым из ряда стран стало трудно общаться с коллегами по всему миру. Война также оказала прямое воздействие на научные исследования в крупных исследовательских центрах, где в начале XX века физики добились существенного прогресса. В условиях войны многие молодые ученые покинули лаборатории и ушли на фронт, оставив более зрелых профессоров вроде Резерфорда продолжать исследования в одиночку. Многие из этих юношей, представителей поколения, которое должно было подхватить идеи Бора и начало подхватывать их в 1913-м, погибли в боях. Война повлияла и на работу нейтральных ученых, хотя в некотором роде они получили преимущество из-за проблем остальных. Сам Бор стал лектором физики в Манчестере, в Геттингене голландец Петер Дебай хорошо изучил структуру кристаллов, используя рентгеновские лучи. В то время Дания и Голландия стали настоящими научными оазисами, и в 1916 году Бор вернулся в Данию, где стал профессором теоретической физики в Копенгагене, а в 1920 году основал исследовательский институт, названный в его честь. Вести от немецкого исследователя Арнольда Зоммерфельда (одного из физиков, которые улучшили модель атома Бора, внесшего в нее такой вклад, что иногда эту модель называют "атомом Бора – Зоммерфельда") могли приходить в нейтральную Данию, а затем от Бора – к Резерфорду, находившемуся в Англии. Прогресс продолжался, но все уже было иначе.
После войны немецких и австрийских ученых многие годы не приглашали на международные конференции, Россия оказалась охвачена пламенем революции, а наука вместе с молодыми исследователями потеряла и свой международный характер. Совершенно новому поколению предстояло подхватить квантовую теорию, которая остановилась в своем развитии на полпути после представления запутанного атома Бора (который, стоит признать, был значительно улучшен благодаря усилиям многих ученых и стал эффективной, хоть и беспорядочной моделью), и привести ее к расцвету. Имена исследователей этого поколения знакомы любому современному физику: Вернер Гейзенберг, Поль Дирак, Вольфганг Паули, Паскуаль Йордан и другие. Представители первого квантового поколения, они все родились и выросли уже после великого открытия Планка (Паули в 1900 году, Гейзенберг в 1901-м, Дирак и Йордан – в 1902-м) и пришли в науку в 1920-х годах. Им не нужно было преодолевать прочно засевшие в сознании идеи классической физики, и они, в отличие от великих ученых вроде Бора, уже не чувствовали необходимости идти на полумеры и сохранять связь с классическими идеями, представляя свои концепции атома. Все это было абсолютно закономерно: вероятно, не было совпадением и то, что с момента открытия Планком уравнения излучения абсолютно черного тела до расцвета квантовой физики прошло всего двадцать шесть лет – ровно столько, сколько нужно было новому поколению физиков, чтобы превратиться в настоящих исследователей. Более старшие ученые, которые все еще принимали активное участие в работе, оставили этому поколению в наследство две идеи, помимо самой постоянной Планка. Первой был атом Бора, который явно показал, что квантовые идеи должны быть вплетены в любую удовлетворительную теорию объяснения атомных процессов. Вторая стала заслугой одного великого ученого того времени, который, казалось, наперекор всему никогда не хватался за идеи классической физики. В 1916 году, в разгар войны работая в Германии, Эйнштейн ввел в атомную теорию понятие вероятности. Это была уловка – еще одно дополнение к атому Бора, благодаря которому его поведение стало похожим на наблюдаемое поведение настоящих атомов. Но эта уловка продлила жизнь атома Бора и сделала его крепкой основой истинной квантовой теории – хотя по иронии судьбы впоследствии Эйнштейн сам же отказался от нее, как известно, заявив: "Бог не играет в кости".
Элемент случайности: боги игральные кости
Еще в начале 1900-х годов, когда Резерфорд с коллегой Фредериком Содди изучали природу радиоактивности, они открыли необычное и фундаментальное свойство атома, или, точнее, его ядра. Радиоактивный "распад", как это называется сегодня, подразумевал фундаментальные изменения в атоме (сегодня мы знаем, что причиной является распад ядра и вылет его осколков), происходившие без внешнего воздействия. Радиоактивный распад идет независимо от того, подогреть или охладить атом, поместить его в вакуум или в ведро с водой. Казалось, что невозможно точно предсказать, когда определенный атом радиоактивного вещества подвергнется распаду, испустив альфа– или бета-частицу и гамма-лучи, однако эксперименты показали, что из большого числа радиоактивных атомов в заданный промежуток времени будет всегда распадаться определенная часть. Для каждого радиоактивного элемента существует характерное время, называемое периодом полураспада, за которое распадается ровно половина атомов. Например, период полураспада радия составляет 1600 лет. Радиоактивной формы углерода – углерода-14 – чуть меньше 6000 лет, что делает его полезным при определении археологических возрастов. А период полураспада радиоактивного калия составляет 1300 миллионов лет.
Не зная, что заставляет один атом из множества распадаться, в то время как его соседи остаются целыми, Резерфорд и Содди использовали это открытие для вывода статистической теории радиоактивного распада. В этой теории применялись актуарные методы расчета, сходные с теми методами, которые используются страховыми компаниями, понимающими, что, хотя некоторые из застрахованных ими людей скончаются в молодом возрасте и их наследники получат от страховщиков выплаты, значительно превосходящие суммы уплаченных страховых взносов, другие клиенты проживут долгие жизни и внесут достаточное количество взносов, чтобы компенсировать это. Хотя страховые компании не могут знать, когда умрет каждый из их клиентов, актуарные таблицы помогают их бухгалтерам сводить баланс. В некотором роде статистические таблицы позволили физикам свести баланс радиоактивного распада, учитывая, что речь в данном случае шла об огромных скоплениях атомов.
В связи с этим интересно, что радиоактивность никогда не исчезает полностью из радиоактивного вещества. Из миллионов атомов половина распадается за определенное количество времени. В течение следующего периода полураспада – ровно такого же отрезка времени – распадается половина оставшихся атомов и так далее. Количество радиоактивных атомов, остающихся в веществе, становится с каждым разом все меньше, стремясь к нулю, но каждый шаг в сторону нуля проходит только половину расстояния до него.
В те дни физики вроде Резерфорда и Содди полагали, что в конце концов кто-нибудь поймет, что именно заставляет распадаться каждый отдельный атом, и это открытие объяснит статистическую природу процесса. Когда Эйнштейн применил статистические методы к модели Бора, чтобы объяснить детали атомных спектров, он тоже предположил, что последующие открытия отбросят необходимость в "актуарных таблицах". Они все ошибались.
Энергетические уровни атома или электрона в атоме можно представить как лестничный пролет. Высоты каждой ступеньки не эквивалентны с точки зрения энергии – верхние уровни располагаются ближе друг к другу, чем нижние. Бор показал, что в случае водорода (простейшего атома) энергетические уровни могут быть представлены в виде лестницы, у которой высота каждой ступени, ведущей к вершине, пропорциональна 1 /гг, где n – это номер каждой ступени при счете снизу. Переход с первого уровня этой лестницы на второй требует, чтобы электрон поглотил ровно столько энергии hv, сколько необходимо для перехода на следующую ступеньку; если электрон падает обратно на первый уровень (на "основной уровень" атома), он испускает точно такое же количество энергии. Электрон с основного уровня не может поглотить меньшее количество энергии, потому что не существует промежуточной "ступеньки", на которой он может остановиться. Точно так же электрон со второго уровня не может испустить меньше кванта энергии, поскольку он не может спуститься никуда, кроме как на основной уровень. Так как существует множество ступеней, на которых может остановиться электрон, и так как он может перепрыгивать туда-обратно с любой ступени на любую другую, в спектре каждого элемента множество линий. Каждая линия соотносится с переходом между ступенями – между энергетическими уровнями с разными квантовыми числами. Например, все переходы, которые оканчиваются на основном уровне, производят спектральные линии, подобные серии Бальмера; все переходы с более высоких уровней на второй соответствуют другому набору линий и так далее. В горячем газе атомы постоянно сталкиваются друг с другом, а потому электроны поднимаются на высокие энергетические уровни и затем падают назад, излучая при этом яркие линии спектра. Когда свет проходит сквозь холодный газ, электроны основного уровня набирают энергию, в процессе этого поглощая свет и оставляя темные линии в спектре.
Если модель атома Бора имела хоть какое-то значение, то это объяснение того, как горячие атомы излучают энергию, должно было быть связано с законом Планка. Спектр излучения абсолютно черного тела должен был представлять собой комбинированный эффект излучения энергии множеством атомов в процессе того, как электроны перепрыгивали с одного энергетического уровня на другой.
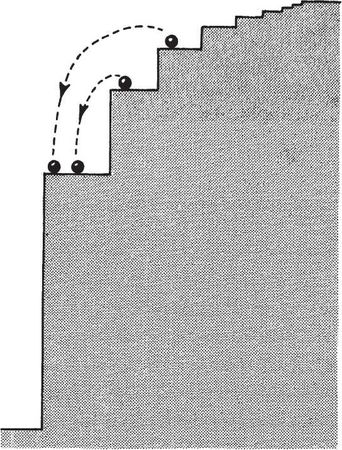
Рис. 4.1. Энергетические уровни в простом атоме вроде атома водорода можно сравнить с набором ступеней, имеющих различную высоту. Мяч, помещаемый на различные ступени, символизирует электрон на различных энергетических уровнях атома. Движению вниз с одного уровня на другой соответствует высвобождение определенного количества энергии, связанной в атоме водорода со спектральными линиями серии Бальмера. Промежуточных линий не существует, поскольку нет промежуточных "ступеней" для электрона.
В 1916 году Эйнштейн завершил работу над своей общей теорией относительности и снова обратился к квантовой теории (в сравнении с его главным трудом это, должно быть, казалось для него отдыхом). Возможно, он был вдохновлен успехом модели атома Бора и тем фактом, что как раз в это время его новая версия корпускулярной теории света наконец-то начала обретать признание. В 1905 году, когда Эйнштейн только опубликовал свою интерпретацию фотоэлектрического эффекта, одним из его главных оппонентов стал американский физик Роберт Эндрюс Милликен. Он десять лет проверял эту идею в серии блестящих опытов, начав их с целью доказать, что Эйнштейн был неправ, и закончив в 1914 году обнаружением прямого экспериментального доказательства того, что объяснение фотоэлектрического эффекта с помощью световых квантов, или фотонов, предложенное Эйнштейном, было верным. В процессе этих экспериментов он опытным путем установил точное значение h ив 1923 году по иронии судьбы получил Нобелевскую премию за свои исследования и измерение заряда электрона.
Эйнштейн понял, что переход атома из "возбужденного" энергетического состояния – с электроном на высоком энергетическом уровне – в состояние с меньшей энергией во многом сходен с радиоактивным распадом атома. Он использовал статистические методы, развитые Больцманом (для оперирования с поведением групп атомов), чтобы исследовать индивидуальные энергетические состояния, рассчитывая вероятность того, что определенный атом окажется в энергетическом состоянии, соответствующем определенному квантовому числу n. Он использовал вероятностные "актуарные таблицы" радиоактивности, чтобы выяснить вероятность "распада" атома из состояния n в другое состояние с меньшей энергией (то есть с меньшим квантовым числом). Все это ясным и простым путем привело к формуле Планка для излучения абсолютно черного тела, полученной всецело на основании квантовых идей. Вскоре, используя статистические идеи Эйнштейна, Бор сумел расширить свою модель атома, включив в нее объяснение большей четкости одних линий по сравнению с другими: так происходило из-за того, что некоторые переходы между энергетическими состояниями были более вероятны – могли случиться скорее, чем другие. Он не мог объяснить, почему все было именно так, но в то время это никого особенно не волновало.
Как и многие люди, изучавшие в те дни радиоактивность, Эйнштейн верил, что актуарные таблицы не были последним словом в этих расчетах и что последующие исследования объяснят, почему конкретный переход происходил в четко определенное время, а не в какое-нибудь другое. Но как раз тогда квантовая теория стала окончательно откалываться от классических идей, и никакой "глубинной причины", по которой радиоактивный распад или энергетические переходы внутри атома происходят в конкретный момент времени, так и не было обнаружено. И правда, кажется, что эти изменения происходят исключительно по воле случая, на статистической основе, и уже из-за этого возникают фундаментальные философские вопросы.
В классическом мире ничего не происходит без причины. Причину любого события можно отследить дальше, чтобы обнаружить причину причины, а затем выяснить, что вызвало ее – и так далее до самого Большого взрыва (если вы космолог) или до момента сотворения мира в религиозном смысле (если вы придерживаетесь этой модели). Но в квантовом мире эти прямые причинно-следственные связи исчезают, стоит только взглянуть на радиоактивный распад и атомные переходы. Электрон не передвигается с более высокого энергетического уровня на более низкий в конкретный момент и по конкретной причине. Более низкий энергетический уровень статистически желаннее для атома, поэтому высока вероятность (а уровень вероятности можно даже проквантовать), что рано или поздно электрон совершит этот переход. Но нет возможности установить, когда случится такой переход. Никакая внешняя сила не толкает электрон и никакой внутренний механизм не отсчитывает время прыжка. Это просто происходит без определенных причин в какой-то момент времени.
Это не полное нарушение причинно-следственной связи. Хотя многие ученые XIX столетия пришли бы в ужас от этой идеи, я сомневаюсь, что хоть кто-то из читателей обеспокоен ею. Но это только верхушка айсберга, первый намек на истинную странность квантового мира, о котором стоит упомянуть, хотя его истинное значение в то время еще не разглядели. Признание пришло в 1916 году, и пришло оно от Эйнштейна.
Атомы в перспективе
Нам пришлось бы долго и нудно перечислять все мельчайшие усовершенствования модели атома Бора, которые были сделаны до 1926 года, а потом обреченно сказать, что большинство этих дополнений, стремившихся к истине, все равно было ошибочно. Однако атом Бора так прочно вошел в учебники и популярную литературу, что невозможно совсем обойти его вниманием. В своей итоговой версии он стал практически последней моделью атома, которая хоть как-то напоминает тот образ, к которому мы привыкли в обычной жизни.