Дифференциальная диагностика
Диагностика активного ревматического процесса у больных с ранее сформировавшимся пороком сердца не представляет особых трудностей. Первичный ревматизм, протекающий без ярких клинических признаков, весьма сходен с другими заболеваниями, что заставляет проводить дифференциальную диагностику в первую очередь с инфекционно-аллергическим миокардитом.
Для первичного ревмокардита, в отличие от инфекционно-аллергического миокардита, характерны:
1. связь заболевания с носоглоточной стрептококковой инфекцией;
2. латентный период с момента окончания предшествующего инфекционного заболевания до первых клинических признаков ОРЛ, составляющий 2–4 нед;
3. преимущественное возникновение болезни в детском и юношеском возрасте;
4. обнаружение полиартрита или острых артралгий в качестве начальных симптомов болезни;
5. отсутствие жалоб на нарушения со стороны сердца или их констатация лишь при целенаправленном сборе анамнеза;
6. частое обнаружение объективных симптомов поражения сердца;
7. четкая корреляция выраженности клинических признаков ревматизма с лабораторными показателями активности ревматического процесса.
При ревмокардите отсутствует хронологическая связь с нестрептококковыми инфекциями, стрессовыми воздействиями; латентный период всегда присутствует и не укорочен.
Инфекционно-аллергический миокардит отмечают у лиц молодого, среднего, пожилого возраста; он характеризуется постепенным началом, отсутствием суставного синдрома в начале болезни; лабораторные признаки активности могут отсутствовать при наличии выраженных признаков кардита; отмечаются астенизация и вегетативная дисфункция.
Первичный ревмокардит следует дифференцировать от так называемых функциональных заболеваний сердца (см. "Нейроциркуляторная дистония"). Общими для обоих заболеваний служат "кардиальные" жалобы, связь ухудшения состояния с перенесенной инфекцией, субфебрилитет, молодой возраст.
Углубленный анализ симптомов показывает, что при первичном ревмокардите, в отличие от НЦД, нет связи начала болезни с разнообразными стрессорными воздействиями, отсутствуют астеноневротические "кардиальные" жалобы (ощущение остановки, замирания сердца), так называемый респираторный синдром (чувство нехватки воздуха, неудовлетворенность вдохом) и вегетативно-сосудистые кризы. В то же время при НЦД есть длительный анамнез, и больные попадают в поле зрения врача во время очередного обострения болезни. При этом не выявляются признаки поражения миокарда (увеличение размеров, глухость I тона, систолический шум, трехчленный ритм в сочетании с тахикардией), нет и лабораторных острофазовых показателей, а также измененных иммунологических показателей. Эффект седативной терапии и применения β-адреноблокаторов отчетливо выражен.
Если в клинической картине первичного ревматизма доминирует поражение суставов (выраженный полиартрит), то дифференциальную диагностику необходимо проводить с реактивными артритами (развивающимися в ответ на кишечную или урогенитальную неспецифическую инфекцию), а также с СКВ. Основу отличия ревматизма от этих заболеваний составляют такие признаки, как эпидемиологический анамнез, частое сочетание полиартрита с поражением сердца, быстрая динамика клинической симптоматики под влиянием противоревматической терапии.
Иногда ОРЛ необходимо дифференцировать от антифосфолипидного синдрома, который может манифестировать поражением клапанного аппарата и развитием хореи, при этом следует учитывать анамнестические данные и результаты определения антифосфолипидных антител.
Распознавание активного ревматического процесса у больных со сформированным пороком сердца (возвратного ревмокардита) основано на тех же диагностических критериях, но данные физикального обследования, а также инструментальные и рентгенологические показатели в гораздо большей степени будут обусловлены существующим пороком сердца, а не активным ревматическим процессом. В связи с этим при диагностике рецидива болезни следует ориентироваться на связь ухудшения состояния больного (возникновение или нарастание симптомов сердечной недостаточности) с перенесенным инфекционным заболеванием, существование артралгий, субфебрильной температуры тела и лабораторных показателей активности ревматического процесса (острофазовых и иммунологических).
Возвратный (рецидивирующий) ревмокардит на фоне того или иного порока сердца в сочетании с сердечной недостаточностью следует дифференцировать от инфекционно-аллергического (неспецифического) миокардита тяжелого течения. Основным при этом считают отсутствие "ревматического" анамнеза, признаков клапанного порока сердца и лабораторных показателей активности при миокардите.
Формулировку развернутого клинического диагноза осуществляют в соответствии с классификацией и номенклатурой ревматизма.
Она должна включать следующие пункты:
1. активность (степень активности) процесса или ремиссия;
2. характер поражения сердца;
3. существование (отсутствие) поражения других органов и систем;
4. характер течения;
5. состояние кровообращения.
Лечение
В настоящее время лечение ревматизма проводят в три этапа:
1. лечение в активной фазе в стационаре;
2. продолжение лечения больного после выписки в кардиоревматологических кабинетах поликлиники;
3. последующее многолетнее диспансерное наблюдение и профилактическое лечение в поликлинике.
Лечебные мероприятия включают:
1. борьбу со стрептококковой инфекцией;
2. подавление активного ревматического процесса (воспаление на иммунной основе);
3. коррекцию иммунологических нарушений.
На первом этапе (стационарном) рекомендовано соблюдение постельного режима в течение 2–3 нед, питание с ограничением хлорида натрия (поваренной соли) и достаточным количеством полноценных белков (не менее 1,0–1,5 г на 1 кг массы тела).
Этиотропную терапию осуществляют бензилпенициллином, оказывающим бактерицидное действие на гемолитические стрептококки группы А. Бензилпенициллин назначают в дозе 1,5–4 млн ЕД в течение 10 дней. Вместо бензилпенициллина можно использовать полисинтетические пенициллины (ампициллин, оксациллин и пр.). При индивидуальной непереносимости пенициллинов применяют макролиды: спирамицин по 6 млн МЕ в 2 приема в течение 10 дней; азитромицин в дозе 0,5 г 1 раз в день в течение 3 дней; рокситромицин по 0,3 г в 2 приема в течение 10 дней.
Активный ревматический процесс купируют различными НПВС. Преимущество отдают диклофенаку – наиболее эффективному средству, оказывающему наименее выраженное побочное действие. Суточная доза этого препарата составляет 100 мг. Его следует принимать до полной ликвидации активности ревматического процесса.
При высокой активности (III степень), тяжелом первичном ревмокардите с признаками сердечной недостаточности (что чаще встречается у лиц молодого возраста) или признаками полисерозита показаны глюкокортикоидные препараты (преднизолон в дозе 1,0–1,5 мг/кг массы тела). По достижении клинического эффекта (обычно – через 2 нед) дозу постепенно снижают с последующим назначением НПВС.
При вялотекущем процессе большего эффекта достигают от проведения иммуносупрессивной терапии (коррекция иммунного гомеостаза) с помощью аминохинолиновых производных – гидроксихлорохина и хлорохина. Эти препараты назначают по 0,2 и 0,25 г соответственно, 1–2 раза в сутки в течение длительного времени (не менее одного года). Спустя год дозу можно уменьшить в 2 раза.
На втором этапе (поликлиническом) медикаментозное лечение следует продолжать в тех же дозах, которые больной принимал при выписке из стационара. Длительность приема противовоспалительных препаратов при остром течении обычно составляет 1 мес, при подостром – 2 мес. Как было отмечено ранее, аминохинолиновые препараты принимают длительно (1–2 года).
Поликлинический этап также предусматривает проведение после перенесенной атаки ОРЛ обязательной антибиотикопрофилактики. Назначают пенициллин пролонгированного действия – бензатина бензилпенициллин в дозе 2,4 млн ЕД внутримышечно 1 раз в 3 нед: для больных, перенесших ОРЛ без отчетливого кардита, – не менее 5 лет или до достижения возраста 18 лет; для больных с излеченным ревмокардитом без порока сердца – не менее 10 лет или до достижения возраста 25 лет; для больных со сформированным пороком сердца, в том числе и оперированным, – пожизненно.
В задачу третьего этапа входит пребывание детей и подростков в местном ревматологическом санатории, а у взрослых – направление на реабилитацию в кардиологический санаторий.
При хроническом тонзиллите хирургическое лечение проводят только при неэффективности консервативного, а также в случаях, если обострение тонзиллита приводит к рецидиву ОРЛ.
Больным с сердечной недостаточностью проводят соответствующую терапию ингибиторами АПФ, мочегонными средствами, β-адреноблокаторами (см. "Сердечная недостаточность").
Больных, перенесших ОРЛ, ставят на диспансерный учет не только с целью проведения противорецидивного лечения, но и для своевременной диагностики рецидива ОРЛ, а при прогрессировании клапанного порока – для направления в кардиохирургический стационар.
Прогноз
Непосредственная угроза для жизни при ОРЛ возникает крайне редко. Прогноз определяет выраженность порока сердца и состояние сократительной функции миокарда.
Профилактика
Первичная профилактика состоит из комплекса общественных и индивидуальных мер, направленных на предупреждение первичной заболеваемости (повышение жизненного уровня, пропаганда здорового образа жизни, в частности закаливания, улучшение жилищных условий, борьба со скученностью в детских садах, школах, общественных учреждениях).
Важным фактором служит раннее и эффективное лечение ангин и других острых стрептококковых заболеваний верхних дыхательных путей. Это достигается назначением пролонгированных форм пенициллина. При непереносимости бензилпенициллина можно назначать эритромицин в течение 10 дней.
Любое лечение ангины должно продолжаться не менее 10 дней, что приводит к полному излечению стрептококковой инфекции.
Профилактика рецидива ревматической лихорадки (вторичная профилактика) должна назначаться в стационаре сразу после окончания 10-дневного лечения пенициллинами (макролидами). Классический режим – применение бензатина бензилпенициллина по 2,4 млн ЕД внутримышечно 1 раз в 3–4 нед. Чем меньше возраст больного при первой атаке, тем больше вероятность рецидива. После пятилетнего наблюдения частота рецидивов, как правило, снижается с возрастом. Больные, у которых во время предыдущих атак было установлено минимальное поражение сердца, должны получать противорецидивную профилактику минимум до достижения возраста 40 лет. Пациентам, перенесшим операцию на сердце по поводу ревматического порока сердца, вторичную профилактику проводят пожизненно.
Инфекционный эндокардит
Инфекционный эндокардит (ИЭ) – полипозно-язвенное поражение клапанного аппарата сердца или пристеночного эндокарда (реже эндотелия аорты или крупной артерии), вызванное различными патогенными микроорганизмами или грибами и сопровождающееся тромбоэмболиями, а также системным поражением сосудов и внутренних органов на фоне измененной реактивности организма.
Термин "инфекционный эндокардит" в настоящее время вытеснил ранее использовавшиеся термины "бактериальный эндокардит", "затяжной септический эндокардит", так как лучше отражает причину заболевания, вызываемого самыми различными микроорганизмами – бактериальными агентами, риккетсиями, вирусами и грибами.
Наиболее часто заболевают ИЭ лица в возрасте 20–50 лет, мужчины несколько чаще, чем женщины. Особенность "современного" ИЭ состоит в высокой частоте возникновения заболевания в пожилом и старческом возрасте (более 20% всех случаев), увеличении числа больных с первичной формой болезни (более 50%), возникновении новых клинических вариантов течения и в значительном изменении свойств возбудителя.
Этиология
Среди возбудителей, наиболее часто вызывающих ИЭ, обнаруживают кокковую микрофлору – стрептококки (зеленящий стрептококк ранее выделяли в 90% случаев), стафилококки (золотистый, белый) и энтерококки. Значительно реже причиной болезни бывает грамотрицательная микрофлора – кишечная палочка, синегнойная палочка, протей и клебсиелла. В последние годы большую роль стали играть патогенные грибы, протей, сарцины, бруцеллы, вирусы. У ряда больных истинного возбудителя заболевания не обнаруживают (частота получения отрицательного результата при посеве крови колеблется в пределах 20–50%). Обнаружение возбудителя зависит от многих факторов: качества бактериологического исследования, длительности предшествующей антибактериальной терапии и особенностей возбудителя.
Источники инфекции и бактериемии при ИЭ могут быть самыми разными.
1. Операции в полости рта.
2. Операции и диагностические процедуры на органах мочеполовой системы.
3. Инфекционное поражение кожи.
4. Оперативное вмешательство на сердечно-сосудистой системе (в том числе протезирование клапанов).
5. Длительное пребывание катетера в вене.
6. Частые внутривенные вливания и эндоскопические методы исследования.
7. Хронический гемодиализ (артериовенозный шунт).
8. Наркомания (внутривенное введение наркотиков).
ИЭ может развиться на интактных клапанах (первичный эндокардит), а также на фоне ранее существовавших (врожденных и приобретенных) изменений сердца и его клапанного аппарата (вторичный ИЭ).
Имеет значение в развитии ИЭ и ряд медицинских манипуляций (оперативные вмешательства в полости рта, катетеризация мочевого пузыря, ректороманоскопия, установка внутривенного катетера). Наконец, имеет также значение ряд состояний, сопровождающихся снижением иммунитета: сахарный диабет, токсикомания (в том числе алкоголизм), ВИЧ-инфекция, лечение мощными иммунодепрессантами. В настоящее время приобрел большое значение ИЭ наркоманов.
Патогенез
Механизм развития заболевания сложен и изучен недостаточно, но основные моменты развития ИЭ не вызывают сомнения (рис. 2–2). При существовании в организме очага инфекции под влиянием различных эндогенных и экзогенных факторов, изменяющих реактивность и иммунный статус организма, развивается бактериемия.
Микроорганизмы из крови попадают на клапаны сердца, где в дальнейшем формируют вторичный очаг инфекции. Их фиксации и размножению на эндокарде, приводящем к образованию вторичного септического очага, способствуют дополнительные факторы. Вероятно, имеет значение предшествующее изменение ткани и поверхности клапана, а также присутствие на нем тромботических масс (часто – с развитием абактериального эндокардита), образующихся под влиянием прямого повреждающего действия струи крови, движущейся с большой скоростью или под большим давлением (в условиях имеющегося порока сердца). Деформация клапанов вследствие большого градиента давления, узости отверстия и изменения скорости кровотока создает условия, способствующие внедрению инфекционных агентов в эндокард с образованием инфекционного очага.
При поражении ранее интактного клапана происходят изменения, нарушающие нормальные свойства отдельных участков этого клапана в виде отечности, экссудативных или пролиферативных процессов ("интерстициальный вальвулит" – доклиническая фаза). Подобная ситуация возможна и при повреждении интимы крупных сосудов.
Происходит снижение иммунитета (в основном клеточного) с развитием вторичных иммунных нарушений (наряду с бактериальными антигенами существуют и антигены тканевого происхождения, что приводит к образованию иммунных комплексов, которые циркулируют в крови и оседают на различные органы и ткани). Патогенез представлен на рис. 2–2.
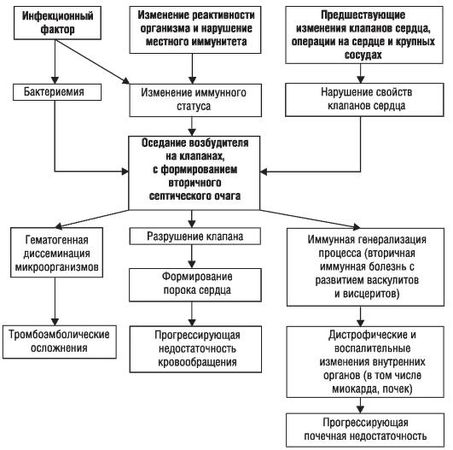
Рис. 2–2. Патогенез инфекционного эндокардита
Классификация
По клиническому течению:
1. острый (заболевание длится не более 1–1,5 мес);
2. подострый (заболевание длится 3–4 мес);
3. затяжной (заболевание длится многие месяцы).
По клинико-морфологической форме:
1. первичный (на интактном сердце) – более 50%;
2. вторичный на фоне:
• ревматических пороков сердца;
• пролапса митрального клапана;
• врожденных пороков сердца;
• ГКМП;
• постинфарктной аневризмы; артериовенозных аневризм;
• оперированного сердца и сосудов;
• шунтов при хроническом гемодиализе.
В клинической картине заболевания принято выделять группы симптомов, обусловленных различными патогенетическими механизмами.
1. Симптомы, обусловленные инфекционно-токсическим воздействием, протекают с интоксикацией различной степени выраженности и с повышением температуры тела. Рост бактерий сопровождает формирование вегетаций с разрушением клапанов (развитие порока сердца). Происходит также генерализация процесса за счет гематогенного распространения инфекции. Отрыв фрагментов клапанных микробных вегетаций способствует заносу инфицированных эмболов в различные участки сосудистого русла и усугубляет септические проявления. Одновременно эмболы, попадая с током крови в различные органы, вызывают развитие тромбоэмболических осложнений, проявляющихся симптомами инфаркта почки, миокарда, селезенки, сосудов глаз, кожи и др.
2. Симптомы, обусловленные иммуновоспалительными механизмами, связаны с иммунной генерализацией процесса. Микроорганизмы, фиксированные на клапанах, вызывают длительную аутосенсибилизацию и гиперергическое повреждение органов и тканей организма. В этой стадии выявляют циркулирующие в крови и фиксированные в тканях (сердце, почки, печень, сосуды) иммунные комплексы. Иммунные и аутоиммунные нарушения обусловливают развитие васкулитов и висцеритов (иммунокомплексный нефрит, миокардит, гепатит, капиллярит и др.). В ряде случаев иммунные нарушения, называемые вторичными, могут развиваться с самого начала болезни, по существу в продромальный период.
1. При дальнейшем прогрессировании болезни могут развиваться дистрофические изменения органов с их функциональной недостаточностью (наибольшее значение имеют сердечная и почечная недостаточность, часто приводящая к смерти больных).