Вопрос 3. Иммунология туберкулеза
1. В предварительных научных исследованиях была охарактеризована роль CD4 T-лимфоцитов. Они играют важную роль в формировании противотуберкулезного иммунитета. Особенно их роль стала понятной в связи с ростом числа больных туберкулезом среди лиц, инфицированных вирусом СПИДа. Среди этой группы больных отмечается особенно высокий рост числа больных с реактивированным латентным туберкулезом. Патогенетическая роль этой популяции лимфоцитов предопределяется их способностью распознавать антигены большого комплекса гистосовместимости (major histocompatibility complex, или в сокращенной форме – MHC ІІ класса). Так распознаются дендритные клетки и макрофаги, в вакуолях которых находится антигенный пептид.
В противоположность этим иммунологическим механизмам MHC – І представлены молекулы антигенов, которые активируют CD8 T-лимфоциты. Этот иммунологический механизм контролирует транспорт антигена из цитоплазмы в эндоплазматический ретикулум. Так как Mycobacterium tuberculosis первично живет в вакуолях больше, чем в цитоплазме клеток, то, казалось, маловероятна роль данной популяции лимфоцитов в формировании противотуберкулезного иммунитета. Однако в исследованиях, которые были проведены Muller et al. (1987), было показано участие CD8 Т-лимфоцитов в механизмах элиминации M. tuberculosis из ткани селезенки экспериментальной линии мышей (gene disrupted).
Антимикробная активность CD8 T-лимфоцитов может достигаться несколькими путями. Лимфоциты этой популяции могут быть источниками продукции таких цитокинов, какими являются интерферон-гамма (IFN-g) и TNF-a. CD8 Т-лимфоциты могут оказывать протективный эффект прямым действием, направленным против макрофагов, находящихся в тканях и захвативших M. tuberculosis. Продукция цитокинов играет важную роль в активации макрофагов. CD4, CD8 Т-лимфоциты секретируют INF-g и TNF-a, концентрация которых возрастает в очаге воспаления. Другой механизм, с помощью которого инфицированные макрофаги поражаются CD8 Т-лимфоцитами, связывают со способностью клеток убивать макрофаги с помощью перфорина. Перфорин является протеином, который синтезируется гранулами CD8 Т-лимфоцитов. С помощью указанного протеина перфорируется мембрана макрофагов, и через них внутрь клетки проникают такие токсические пептиды, какими являются гранзимы или гранулизин, которые ускоряют процесс апоптоза макрофагов. Апоптоз макрофагов может быть также осуществлен через механизм Fas-лиганда, который приводит к активации CD8 Т-лимфоцитов.
Таким образом, CD8 Т-лимфоциты имеют несколько механизмов антимикробного действия, среди которых более изученными являются прямые цитотоксические эффекты, участие в продукции провоспалительных цитокинов, синтез целого ряда пептидов с выраженными токсическими свойствами. Эти клетки могут в значительной степени компенсировать функциональную неполноценность CD4 Т-лимфоцитов.
Недавними исследованиями Stenger S. еt al. (1997) было показано прямое цитотоксическое действие CD8 Т-лимфоцитов, направленное против M. tuberculosis, находящихся внутриклеточно. Этот механизм прямого поражения микобактерий связывают со способностью человеческих лимфоцитов продуцировать гранулизин. Данный механизм невозможно исследовать в экспериментальных условиях, так как лимфоциты животных не вырабатывают этот тип пептида. Однако остается много неизученных вопросов, связанных с генетическими механизмами регулирования кинетики жизненного цикла лимфоцитов, особенностей формирования их воспалительной активности, продукции целого ряда цитокинов, перфорина, гранзимов и других биологически активных веществ.
Каждый Т-лимфоцит имеет специфический эпитоп, или короткую цепь аминокислот в структуре антигена. Идентификация антигенов, или эпитопов является важным этапом в расшифровке механизмов защиты, так как эту информацию необходимо использовать в конструировании нового поколения вакцин. В классическом варианте CD8 Т-лимфоциты распознаются пептидами, входящими в структуру MHC Ia. Эта популяция лимфоцитов способна также распознавать антигены MHC I; при этом имеются ввиду такие молекулы, как CD1 или MHC Ib. Исследование генома микобактерий диктует необходимость получить информацию о роли и месте классического и неклассического пути его взаимодействия с иммунной системой хозяина. Эти данные сегодня имеют значение в трактовке разных клинических проявлений туберкулеза. Так, характеристика классического и неклассического MHC позволила выделить клоны лимфоцитов с повышенной и пониженной продукцией IFN-g. Специфические антигены M. tuberculosis, которые оказывают влияние на противовоспалительную активность Т-лимфоцитов, являются секреторными антигенами и включают такие, как 6, Ag85A, Ag85B, 38 kD, шоковый белок 65 и липопротеин 19 kD. CD8 Т-лимфоциты имеют специфические эпитопы для раннего секреторного антигена 6, который отсутствует в M. bovis, Bacille Calmette – Guerin (BCG). С данным антигеном связывают активацию лимфоцитов и начало продукции интерферона. В настоящее время активно исследуется способность лимфоцитов к продукции интерферона g в зависимости от активности туберкулезного процесса и участия как классического пути MHC–Ia, так и неклассического MHC–Ib. Lalvani A. etal. (1998) установили, что у здоровых индивидуумов, у которых была положительная реакция на туберкулин CD8, Т-лимфоциты синтезируют более низкие концентрации гамма – интерферона, чем у здоровых людей, у которых реакция на туберкулин была отрицательной. При этом было установлено, что более чем в 96 % случаев наблюдался неклассический MHC–Ib.
Таким образом, проведенные исследования в последние годы по установлению роли CD8 Т-лимфоцитов в патогенезе туберкулезного процесса свидетельствуют об их активном участии в формировании иммунологических реакций. Эти данные позволяют рассматривать принципиально новые подходы в конструировании вакцин в борьбе с туберкулезом. Существующие вакцины построены исходя из роли и значения в туберкулезном процессе CD4 Т-лимфоцитов; следует подчеркнуть их низкую эффективность в борьбе с туберкулезом у взрослых. Этот факт имеет большое значение в планировании новых подходов при конструировании вакцин нового поколения. Большое значение следует придать и такому фактору, как способность CD8 Т-лимфоцитов распознавать макрофаги, которые фагоцитировали M. tuberculosis, и приводить их к гибели непосредственно в очаге воспалительной реакции. Однако остается большое количество неизученных вопросов, к которым следует отнести взаимодействие различных популяций лимфоцитов, устойчивость иммунитета, особенно в отдаленные сроки наблюдения, оценку эффективности выработанной стратегии в разработке вакцин нового поколения.
1. Иммунитет при туберкулезе имеет свои особенности. Он нестерильный, т. е. поддерживается бактериями, персистирующими в организме и обеспечивающими состояние инфицированности. Иммунитет неустойчивый, так как те самые бактерии, которые обеспечивают инфицированность, могут явиться причиной эндогенной инфекции. Особенностью является и выработка антител, т. е. гуморальный иммунный ответ, не коррелирующий с напряженностью иммунитета, и таким образом, антитела не играют существенной роли в противотуберкулезном иммунитете. Антитела являются лишь "свидетелями" иммунитета и не оказывают ингибирующего действия на возбудителя. И наконец, основной механизм противотуберкулезного иммунитета – клеточный. Реализация его осуществляется через гиперчувствительность замедленного типа с ярко выраженным аллергическим компонентом и механизмы неспецифической защиты – антимикробную резистентность, которая осуществляется за счет активности системы комплемента и фагоцитов, но фагоцитоз часто при этом остается незавершенным.
Вопрос 4. Эпидемиология туберкулеза
Основной источник заражения – больной человек, т. е. бациллярный больной, который выделяет большое количество микобактерий в мокроте, но также может быть и крупный рогатый скот (через молоко и молочно-кислые продукты от больных коров – M. bovis), и домашняя птица (через яйца от больных кур – M. avium).
Основным путем заражения это воздушно-капельный, но нельзя исключать и контактно-бытовой. По эпидемиологической опасности различают открытую и закрытую формы туберкулеза. При открытой форме в мокроте обнаруживаются микобактерии туберкулеза, поэтому такие больные представляют опасность для окружающих. При закрытой форме в мокроте микобактерии не определяются, больные неопасны для окружающих, но при прогрессировании болезни или переходе в фазу обострения инфекционного процесса закрытая форма может перейти в открытую, и тогда такие больные становятся источником заражения для окружающих.
Различные факторы, угнетающие иммунную систему, неблагоприятно отражаются на течении туберкулеза: при этом утяжеляется течение заболевания, учащаются обострения, замедляется обратное развитие процесса и возрастает частота рецидивов. Факторы, способствующие заболеванию туберкулезом: неблагоприятные социальные и экологические условия жизни, неполноценное питание, алкоголизм, курение, наркомания, снижение иммунитета, стрессы, наличие сопутствующих заболеваний (диабета, язвенной болезни желудка или двенадцатиперстной кишки, заболеваний легких).
Существует ряд болезней, носители которых составляют группу повышенного риска по заболеваемости туберкулезом: хронические неспецифические заболевания легких (ХНЗЛ) – хронический бронхит, пневмосклероз, бронхоэктазы и другие; затяжное течение острых заболеваний органов дыхания; перенесшие экссудативный или рецидивирующий сухой плеврит; перенесшие обширные травмы грудной клетки и полостные операции; сахарный диабет; гиперергические реакции на туберкулин; СПИД; беременные женщины.
По наследству туберкулез не передается, как правило, дети от больных родителей рождаются здоровыми, но если родители не лечатся активно, не соблюдают мер предосторожности, то ребенок может заразиться.
Как известно, туберкулез относится к числу так называемых социальных болезней, возникновение которых связано с условиями жизни населения. Речь идет прежде всего о таких факторах, как неблагоприятные условия труда и быта, неполноценное питание, загрязненность окружающей среды, психологические перегрузки, усиливающиеся миграционные процессы. Эпидемиологическую обстановку по туберкулезу характеризуют такие статистические показатели, как инфицированность, заболеваемость, болезненность и смертность. Инфицированность – это процентное отношение числа лиц, положительно реагирующих на туберкулин, по отношению к числу обследованных, за исключением числа лиц с поствакцинальной аллергией. Заболеваемость – число впервые выявленных больных активным туберкулезом в течение года в расчете на 100 тыс. населения. Болезненность – общее число больных активным туберкулезом, состоящих на учете в лечебных учреждениях на конец года, в расчете на 100 тыс. населения. Смертность – число лиц, умерших от туберкулеза в течение года, в расчете на 100 тыс. населения.
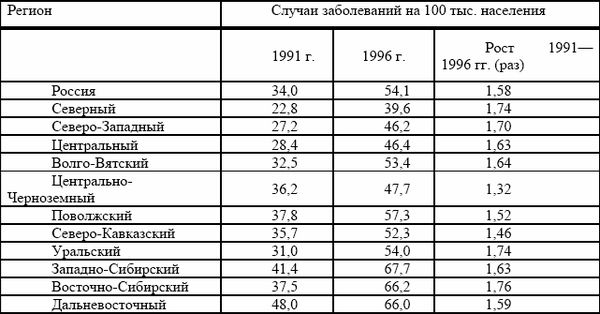
Наиболее неблагоприятная ситуация по заболеваемости активным туберкулезом (см. таблица № 1) сложилась в Западно-Сибирском (67,7 случаев на 100 тыс. населения), Восточно-Сибирском (66,2) и Дальневосточном (66,0) регионах.
Таблица № 1. заболеваемость активным туберкулезом в различных регионах.
Неблагоприятные тенденции в заболеваемости туберкулезом, в том числе туберкулезом легких, продолжались и в 1996 г. В целом по России заболеваемость выросла на 9,4 %. При среднем по России показателе заболеваемости туберкулезом детей 11,5 в 1995 г. и 12,6 в 1996 г. на 100 тыс. детского населения. Эти показатели в ряде регионов значительно выше и составляют в республиках Бурятия (соответственно 43,0 и 56,7), Алтай (28,0 и 31,6), Якутия (46,7 и 46,6), Тыва (82,8 и 89,9), Северная Осетия (55,4 и 65,6), Магаданской (31,8 и 61,4) и Камчатской (99,1 и 131,4) областях. Резко возрос показатель инфицированности детей – 2,5 % (вираж туберкулиновой реакции), который при благополучной ситуации не превышает 0,1 %.
Мужчины во всех регионах болеют туберкулезом в 3,2 раза чаще женщин, при этом темпы роста заболеваемости у мужчин в 2,5 раза выше, чем женщин. Наиболее подверженными являются лица в возрасте 20–29 и 30–39 лет, заболеваемость которых в 1995 г. составила 81,2 на 100 тыс.
Позднее выявление больных и недостаточное выделение средств на лекарственное обеспечение снижают эффективность лечения и увеличивают выход на инвалидность. В 1995 г. на 1 умершего больного туберкулезом приходилось только 1,6 излеченных больных (в 1990 г. – 4,6), удельный вес умерших от туберкулеза больных, состоящих на учете в противотуберкулезных учреждениях менее 1 года, увеличился с 8 до 18,0 %.
Вследствие позднего выявления больных резко увеличилась заболеваемость людей, контактировавших в очагах с больными. В 1995 г. этот показатель составил 603,4 на 100 тыс. контактировавших, наиболее часто в очагах заболевают подростки (789,1). Только 70 % работающих в животноводстве (даже в хозяйствах, неблагополучных по заболеванию туберкулезом крупного рогатого скота) проходят обязательные предварительный при поступлении и периодические осмотры, вследствие чего среди этих групп выявляются до 35 % тяжелых хронических больных.
О том, что медицинские работники, контактирующие с больными туберкулезом различных форм, являются реальной группой риска, свидетельствуют следующие цифры: в 1998 г. по республике зарегистрировано 54 случая заболевания туберкулезом: среди заболевших 8 человек – врачи, 35 – средний медперсонал, 11 – санитарки.
W. Stead (1995) проанализировал интенсивность контакта с туберкулезной инфекцией персонала 6 больниц и 22 частных клиник и установил, что туберкулезное инфицирование медицинских работников может быть обнаружено с помощью реакции Манту. Лиц, реагирующих на контакт с туберкулезной инфекцией, автор делит на три группы:
1-я группа – лица, проявляющие конверсию (у них риск туберкулеза оправдывает превентивную химиотерапию независимо от возраста);
2-я группа – лица, реагирующие на туберкулиновый тест (относительно них отсутствуют данные о результатах пробы до контакта); их следует лечить как проявляющих конверсию;
3-я группа – лица, у которых ранее туберкулиновая проба была положительной (у них риск туберкулеза невелик, и лечение считается нецелесообразным).
Однако лица моложе 35 лет, ВИЧ-инфицированные, получающие химиотерапию онкологические больные, принимающие кортикостероиды в течение длительного времени или страдающие еще каким-либо иммуннодефицитным заболеванием должны быть подвергнуты превентивной терапии независимо от результатов туберкулиновой пробы.
Вопрос 5. Первичный туберкулез
Для туберкулеза характерны многообразные морфологические изменения от остронекротических казеозных очагов до малых изменений, параспецифических и неспецифических реакций тканей на микобактерию туберкулеза (МБТ). Различают 3 основных вида патолого-морфологических изменений: первичный, гематогенный и вторичный туберкулез.
Первичный туберкулез
Первичный туберкулез развивается при первом соприкосновении организма человека с микобактерией. Заражение происходит аэрогенным путем чаще всего, и возбудитель оседает в легких, но возможно и алиментарное заражение. Первичный туберкулез встречается, в основном, в детском возрасте, и по существу все проявления туберкулеза у детей являются различными вариантами течения первичного туберкулеза. Морфологическим выражением первичного туберкулеза является первичный туберкулезный комплекс, характеризующийся триадой признаков:
1) очаг в пораженном органе (первичный очаг, или аффект);
2) воспаление отводящих лимфатических сосудов (лимфангит);
3) туберкулезное воспаление в регионарных лимфатических узлах (лимфаденит).
Микобактерия туберкулеза в легких поражает участки с наилучшей аэрацией: субплевральные участки, расположенные в III, VIII, IX, X сегментах чаще правого, чем левого легкого. Здесь в альвеолах развивается очаг экссудативного воспаления, который быстро некротизируется, и вокруг него образуется серозный отек. Так образуется очаг казеозной пневмонии, окруженный зоной перифокального воспаления. Этот очаг называется первичным туберкулезным очагом, или аффектом. Размеры его различны в зависимости от зоны воспаления. Это может быть и альвеолит, но поражаться может и весь ацинус, или долька, реже сегмент. В казеозных массах аффекта длительное время могут сохраняться эластические и аргирофильные волокна каркаса легкого, а по краю казеозных масс обычно обнаруживаются микобактерии. Так как аффект всегда располагается под плеврой, постоянно наблюдается раннее вовлечение ее в воспалительный процесс с развитием фибринозного или серозно-фибринозного плеврита. Может наблюдаться и высыпание бугорков на плевре. Очень быстро специфический воспалительный процесс распространяется на прилежащие к первичному очагу лимфатические сосуды. По ходу тока лимфы к корню легкого развивается лимфостаз, отек ткани и формируются бугорки, расположенные в перибронхиальной и периваскулярной тканях, в межлобулярных перегородках, образующих как бы дорожку от первичного очага к прикорневым лимфатическим узлам. Эта дорожка морфологически и представляет собой лимфангит – второй компонент триады. Однако патологический процесс быстро переходит на регионарные бронхопульмональные, бронхиальные и бифуркационные лимфатические узлы, в которых развивается специфический воспалительный процесс с быстро наступающим казеозным некрозом. Лимфатические узлы быстро увеличиваются и на разрезе представляют собой сплошной некроз. Так возникает тотальный казеозный туберкулезный лимфаденит – третий компонент первичного туберкулеза. В клетчатке средостения, прилежащей к казеозно-измененным лимфатическим узлам, развивается выраженное в той или иной степени перифокальное воспаление, а в более тяжелых случаях встречаются даже очаги творожистого некроза. Так как специфическим процессом поражается всегда группа лимфатических узлов, изменения в них всегда более массивные по сравнению с первичным аффектом. Казеозный лимфаденит обычно является регионарным к участку легкого, где расположен первичный аффект. Возможны три варианта течения первичного туберкулеза: 1) затухание и заживление очагов первичного комплекса; 2) прогрессирование с генерализацией процесса; 3) хроническое течение.