2. За прошедшие полвека антибактериальная терапия (АБТ) непрерывно совершенствуется как путем пополнения арсенала туберкулостатиков, так и за счет разработки новых режимов лечения. Список антибактериальных препаратов (АБП) включает чуть более 10 оригинальных соединений. По эффективности все препараты подразделяются на 3 категории:
1) категория А включает наиболее эффективные: изониазид и рифампицин;
2) категория В – менее эффективные: этамбутол, стрептомицин, протионамид (этионамид), пиразинамид, канамицин, циклосерин, флоримицин (виомицин);
3) категория С – наименее эффективные: ПАСК и тибон (тиоацетазон). Чтобы грамотно распорядиться упомянутым аналогом средств, следует руководствоваться целым рядом принципов, выработанных наукой и практикой за долгие годы борьбы с туберкулезом.
Общие принципы антибактериальной терапии (АБТ).
1. Принцип ранней терапии АБТ предполагает требование выявления туберкулеза на обратимых стадиях эволюции, когда возможно наиболее полное восстановление поврежденных структур.
2. Принцип длительности терапии соблюдается для предупреждения возврата болезни (обострения и рецидива). АБТ не должен быть менее 9 месяцев, так как при кратковременном лечении измененные формы МБТ могут реверсировать в вирулентные.
3. Этиотропное лечение должно быть непрерывным, а иначе возникает вторичная устойчивость БК к лекарственным препаратам, снижается лечебный эффект, создаются условия для хронизации процесса.
4. Принцип комбинированного назначения этиотропных препаратов: включение 3 эффективных медикаментов с разным механизмом противомикробного действия для предупреждения устойчивости МБТ и синергизма противомикробного действия. Монотерапия недопустима.
5. Принцип оптимальных доз АБП вытекает из необходимости создания бактериостатических концентраций препаратов в очаге поражения на протяжении длительного курса терапии при минимуме побочных явлений.
6. Принцип выбора наиболее рациональных путей и методов введения препаратов позволяет индивидуализировать АБТ в ее техническом исполнении. Наиболее употребительные пути: пероральный, внутримышечный, внутривенный, ингаляционный, внутрикавернозный, электрофоретический.
7. Принцип контроля чувствительности МБТ к АБП регламентирует возможности современной замены последних в комбинации для достижения лечебного эффекта.
8. Принцип предупреждения побочных явлений от АБП: с самого начала этиотропное лечение сопровождается лекарственным защитным комплексом, в который входят витамины, десенсибилизирующие препараты, гепатопротекторы, нейропротекторы (глютаминовая кислота, диазепам, ноотропил), некоторые нелекарственные приемы (запивание молоком, временный разрыв в приеме отдельных средств).
9. Наиболее присущим фтизиатрии принципом является соблюдение контроля за приемом каждой дозы препаратов на протяжении всего основного курса терапии.
При выборе химиопрепаратов на различных этапах лечения следует учитывать также их разное влияние на внеклеточно и внутриклеточно располагающиеся МБТ. При свежевыявленном туберкулезе большинство МБТ находятся внеклеточно и активно размножаются. На бактериальную популяцию в этой фазе выраженное действие оказывают практически все АБП. По мере затихания процесса интенсивное размножение МБТ сменяется состоянием персистирования (покоя) бактерий, находящихся внутри фагоцитов. В этой фазе важны препараты, действующие внутриклеточно. Это изониазид, рифампицин, пиразинамид, протионамид, этамбутол. Весь период лечения АБП принято делить на 2 фазы или этапа. Первый этап характеризуется проведением интенсивной химиотерапии, и его назначение – подавить размножение МБТ. Второй этап, менее интенсивной АБТ, фаза долечивания, и назначение ее – воздействие на часть популяции МБТ, находящейся внутриклеточно. Достаточная интенсивность АБТ на первом этапе достигается применением трех, а иногда большего числа АБП ежедневно, а также их внутривенным введением.
Методика химиотерапии впервые выявленных больных.
Основу комбинации АБП у группы больных со свежедеструктивными изменениями в легких составляет сочетание тубазида и рифампицина, а также как 3-й препарат используют стрептомицин, этамбутол, протионамид. При прекращении бактериовыделения и заживлении каверны в течение первых 3 месяцев стрептомицин и рифампицин отменяют и лечение продолжают изониазидом и этмабутолом в течение 6 месяцев после закрытия каверны. Если и через 6 месяцев каверна сохраняется, то применяют рифампицин и этамбутол.
Химиотерапия больных с ограниченными процессами без четко видимых каверн осуществляется 3 препаратами: изониазидом, стрептомицином, этамбутолом.
Методика химиотерапии больных, ранее лечившихся противотуберкулезными препаратами.
В данном случае наиболее эффективными препаратами являются рифампицин, изониазид, пиразинамид, этионамид, протионамид, этамбутол, которые нужно вводить внутривенно и внутрикавернозно. При обнаружении лекарственной устойчивости, а также непереносимости АБП, терапия теряет схематичность и проводится по индивидуальным планам с соблюдением всех основных принципов.
Больные с хроническими поражениями легких нуждаются в проведении АБТ для ликвидации обострения туберкулеза и для прекращения бактериовыделения, когда невозможно хирургическое вмешательство.
В зависимости от путей и способов введения химиопрепаратов, а также от ритма их применения, существуют разные методы АБТ. Например, внутривенное введение в организм больного суточных доз туберкулостатических препаратов.
Вопрос 34. Лечение туберкулеза
1. В связи с различным состоянием микобактериальной популяции на разных этапах болезни научно обоснованным является деление химиотерапии туберкулеза на 2 фазы лечения.
1. Начальная (интенсивная) фаза лечения направлена на подавление быстро размножающейся и активно метаболизирующей микобактериальной популяции и содержащихся в ней лекарственно-резистентных мутантов, уменьшение ее количества и предотвращение развития вторичной резистентности.
Для лечения туберкулеза, вызванного лекарственно-чувствительными микобактериями, применяются 4 противотуберкулезных препарата: изониазид, рифампицин, пиразинамид, этамбутол или стрептомицин в течение 2 месяцев и затем 2 препарата – изониазид и рифампицин в течение 4 месяцев.
Изониазид, рифампицин и пиразинамид составляют ядро комбинации при воздействии на чувствительные микобактерии туберкулеза. При этом необходимо подчеркнуть, что изониазид и рифампицин одинаково эффективно воздействуют на все популяции микобактерий, находящиеся в очаге туберкулезного воспаления. В то же время изониазид бактерицидно воздействует на всех чувствительных к обоим препаратам микобактерий и убивает рифампицинрезистентных возбудителей. В то время как рифампицин также убивает микобактерий, чувствительных к двум этим препаратам, и, что особенно важно, бактерицидно воздействует на изониазидрезистентных микобактерий. Рифампицин эффективно воздействует на персистирующих микобактерий, если они начинают "просыпаться" и усиливать свою метаболическую активность. В этих случаях рифампицин более эффективен, чем изониазид. Присоединение пиразинамида и этамбутола к комбинации изониазида и рифампицина создает условия усиления воздействия их на возбудителя и препятствует формированию резистентности микобактерий.
В случаях лекарственно-устойчивого туберкулеза возникает вопрос использования резервных противотуберкулезных препаратов, комбинации и длительность приема которых еще полностью не разработаны в контролируемых клинических испытаниях и до сих пор носят в основном эмпирический характер.
Комбинация фторхинолона, пиразинамида и этамбутола проявляет активность в отношении штаммов с множественной лекарственной резистентностью, но не достигает уровня активности комбинации изониазида, рифампицина и пиразинамида в отношении чувствительных микобактерий. Это необходимо учитывать при продолжительности интенсивной фазы лечения лекарственно-устойчивого туберкулеза легких.
Длительность и эффективность интенсивной фазы лечения должны основываться на показателях прекращения бактериовыделения по мазку и посеву мокроты, выявленной лекарственной резистентности и положительной клинико-рентгенологической динамики заболевания.
2. Вторая фаза лечения – это воздействие на оставшуюся медленно размножающуюся и медленно метаболизирующую микобактериальную популяцию, в большинстве своем находящуюся внутриклеточно, в виде персистирующих форм микобактерий. На этом этапе главной задачей является предупреждение размножения оставшихся микобактерий, а также стимуляция репаративных процессов в легких с помощью различных патогенетических средств и методов лечения. Лечение необходимо проводить еще в течение длительного периода времени, чтобы обезвредить микобактерии, которые в силу своей низкой метаболической активности плохо поддаются уничтожению с помощью противотуберкулезных препаратов.
Для осуществления второго этапа терапии применяют интермиттирующий метод лечения: АБП даются 2–3 раза в неделю в суточной разовой дозе. (см. таблицу № 5).
Таблица № 5. Оптимальные суточные дозы туберкулостатических препаратов
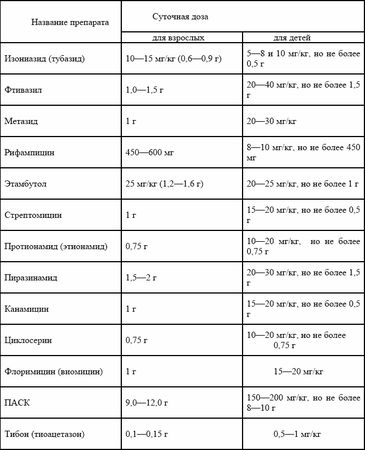
2. Химиотерапия заняла основное место в лечении больных туберкулезом. В России и мире накоплен большой опыт применения противотуберкулезных препаратов, который позволил разработать основные принципы комбинированной химиотерапии больных туберкулезом.
В отечественной фтизиатрии на протяжении всего более чем 50-летнего периода применения противотуберкулезных препаратов осуществлялся клинический подход к оценке эффективности химиотерапии, где всегда ставилась основная задача – добиться не только прекращения бактериовыделения, но и полной ликвидации клинических проявлений болезни, стойкого заживления туберкулезных изменений в пораженном органе, а также максимального восстановления нарушенных функций организма. Это подчеркивается в Концепции национальной российской программы борьбы с туберкулезом, где комбинированная этиотропная химиотерапия является основным компонентом лечения туберкулеза, когда применяются одновременно в течение достаточно длительного времени несколько противотуберкулезных препаратов.
Терапевтический эффект химиотерапии обусловлен антибактериальным действием противотуберкулезных препаратов и направлен на подавление размножения микобактерий туберкулеза (бактериостатический эффект) или их уничтожения (бактерицидный эффект) в организме больного. Только при подавлении размножения микобактерий туберкулеза или их уничтожении возможен запуск адаптационных механизмов, направленных на активацию репаративных процессов и создание в организме больного условий для полного клинического излечения.
Клиническая эффективность противотуберкулезных препаратов определяется многими факторами, среди которых главными являются:
1) массивность самой микобактериальной популяции;
2) чувствительность или резистентность находящихся в ней микобактерий к применяемым препаратам;
3) способность отдельных особей к быстрому размножению;
4) уровень создаваемой бактериостатической концентрации;
5) степень проникновения препаратов в участки поражения и активности в них;
6) способность препаратов действовать на вне– и внутриклеточные (фагоцитированные) микробы;
7) переносимость больными лекарств.
Вопрос 35. Современные режимы химиотерапии туберкулеза легких, вызванного лекарственно-чувствительными и лекарственно-резистентными микобактериями (продолжение)
Основные противотуберкулезные препараты: изониазид (H), рифампицин (R), пиразинамид (Z), этамбутол (E) и стрептомицин (S) являются высокоэффективными в отношении микобактерий, чувствительных ко всем противотуберкулезным препаратам. Следует отметить, что только в России имеются альтернативные изониазиду препараты, такие как феназид, фтивазид и метазид, которые вызывают меньше побочных эффектов.
Намного сложнее стоит вопрос о проведении этиотропного лечения у больных лекарственно-устойчивым туберкулезом легких, когда наиболее важным и определяющим клиническим эффектом химиотерапии является частота и характер лекарственной резистентности микобактерий туберкулеза.
По существующей классификации ВОЗ микобактерии туберкулеза могут быть:
1) монорезистентными к одному противотуберкулезному препарату;
2) полирезистентными к двум и более противотуберкулезным препаратам, но не к сочетанию изониазида и рифампицина;
3) множественно резистентными, как минимум, к сочетанию изониазида и рифампицина.
Особенно тяжело протекают специфические поражения легких у больных с множественной лекарственной резистентностью микобактерий туберкулеза.
Основной фактор риска развития лекарственной резистентности микобактерий туберкулеза – это неэффективное предыдущее лечение, особенно прерванное и незаконченное. В этом плане основная задача в предупреждении развития лекарственной резистентности микобактерий – это правильное лечение впервые выявленных больных туберкулезом с применением современных научно обоснованных и доказательных режимов химиотерапии.
При лечении лекарственно-устойчивого туберкулеза легких используются резервные противотуберкулезные препараты: канамицин (K), амикацин (A), капреомицин (Cap), циклосерин (Cs), этионамид (Et), протионамид (Pt), фторхинолоны (Fq), парааминосалициловая кислота – ПАСК (PAS) и рифабутин (Rfb).
С точки зрения эффективности химиотерапии необходимо представлять, что в очаге активного специфического воспаления могут быть 4 популяции микобактерий туберкулеза, различные по локализации (вне– или внутриклеточно расположенные), лекарственной резистентности и активности метаболизма. Метаболическая активность велика у внеклеточно расположенных микобактерий в стенке каверны или казеозных массах, меньше у внутриклеточных (в макрофагах) и очень низка у персистирующих бактерий.
При прогрессирующем и остро прогрессирующем туберкулезе (инфильтративном, милиарном, диссеминированном, фиброзно-кавернозном и казеозной пневмонии) имеет место интенсивное размножение микобактерий в организме больного, их выход в ткани пораженного органа, распространение гематогенным, лимфогенным и бронхогенным путями, в результате чего появляются участки воспаления, развивается казеозный некроз. Большинство микобактерий в этот период находится внеклеточно, а та часть микобактериальной популяции, которая оказалась фагоцитированной макрофагами, вследствие интенсивного разрушения фагоцитов вновь оказывается расположенной внеклеточно. Следовательно, внутриклеточная локализация микобактерий на этом этапе является сравнительно кратковременным периодом в процессе жизнедеятельности размножающейся микобактериальной популяции.
В плане проведения эффективной химиотерапии важное клиническое значение имеет лекарственная резистентность микобактерий туберкулеза. В большой и активно размножающейся бактериальной популяции всегда имеется небольшое количество диких мутантов, резистентных к противотуберкулезным препаратам в соотношении 1 мутант резистентный к изониазиду или стрептомицину на миллион, 1 – к рифампицину на 100 млн и 1 – к этамбутолу на 100 тыс. чувствительных микобактерий туберкулеза (МБТ). С учетом того что в каверне диаметром 2 см находится 100 млн МБТ, там имеются мутанты ко всем противотуберкулезным препаратам.
При проведении правильной и адекватной химиотерапии эти мутанты практического значения не имеют. Но в результате неправильного лечения, когда назначаются неадекватные режимы химиотерапии и сочетания противотуберкулезных препаратов, неоптимальные дозы при расчете в мг на 1 кг массы тела больного и разделения суточной дозы лекарств на 2–3 приема, изменяется соотношение между количеством резистентных и устойчивых микобактерий. В этих условиях происходит размножение главным образом лекарственно-резистентных микробов – эта часть бактериальной популяции увеличивается.
По мере затихания туберкулезного воспаления при химиотерапии величина микобактериальной популяции уменьшается вследствие разрушения микобактерий. В клинических условиях эта динамика популяции проявляется в уменьшении количества выделяемых больным микобактерий туберкулеза в мокроте, а затем и прекращении бактериовыделения.
В условиях продолжающейся химиотерапии, ведущей к уменьшению микобактериальной популяции и подавлению размножения микобактерий туберкулеза, в организме больного сохраняется часть микобактерий, которые находятся в состоянии персистирования. Персистирующие микобактерии нередко выявляются только при микроскопическом исследовании, так как при посеве на питательные среды они не дают роста. Такие микобактерии называют спящими или дремлющими, иногда – убитыми. В качестве одного из вариантов персистирования микобактерий возможна их трансформация в L-формы, ультрамелкие и фильтрующиеся формы. На этом этапе, когда интенсивное размножение микобактериальной популяции сменяется состоянием персистирования оставшейся ее части, микобактерии нередко находятся главным образом внутриклеточно (внутри фагоцитов).
Изониазид, рифампицин, этионамид, этамбутол, циклосерин и фторхинолоны обладают более или менее одинаковой активностью в отношении внутри– и внеклеточно расположенных микобактерий туберкулеза. Аминогликозиды и капреомицин обладают значительно меньшей бактериостатической активностью на внутриклеточно расположенные микобактерии. Пиразинамид при относительно небольшой бактериостатической активности усиливает действие изониазида, рифампицина, этамбутола и других препаратов, очень хорошо проникает внутрь клеток и обладает выраженной активностью в кислой среде казеоза.
Одновременное назначение нескольких противотуберкулезных препаратов (не менее 4) позволяет завершить курс лечения до появления лекарственной резистентности микобактерий или же преодолеть начальную резистентность их к одному и двум препаратам.
Не менее важной задачей, чем выбор режима химиотерапии, является обеспечение регулярного приема больными назначенной дозы химиотерапии в течение всего периода лечения. Методы, обеспечивающие индивидуальный контроль регулярности приема противотуберкулезных препаратов, тесно связаны с организационными формами лечения в стационарных, санаторных и амбулаторных условиях, когда больной должен принимать назначенные лекарства только в присутствии медицинского персонала. Данный подход в лечении больных туберкулезом является приоритетным для отечественной фтизиатрии и используется в нашей стране с момента появления противотуберкулезных препаратов.