Для профилактики инфекции вводят антибиотики. При профилактических прививках взрослым анатоксин вводится два раза по 0,5 мл на каждую инъекцию с интервалом 30–40 дней между первой и второй прививками. Ревакцинацию проводят через каждые 5–10 лет дозой 0,5 мл препарата. Иммунизация по проведенной схеме создает готовность к быстрой выработке иммунитета при повторном введении анатоксина. Экстренная специфическая профилактика столбняка у непривитых или неправильно привитых людей осуществляется активно-пассивным методом иммунизации. Она показана при возникновении любых механических повреждений независимо от характера, локализации и размера, ожогов и отморожений, исключая I степень. В этих случаях вводят 0,5 мл очищенного адсорбированного столбнячного анатоксина.Через 30–40 дней после проведения такой активно-пассивной профилактики столбняка необходимо продолжить иммунизацию и сделать инъекции 0,5 мл анатоксина, а затем для создания прочного иммунитета ревакцинировать такой же дозой (0,5 мл) препарата через 9–12 месяцев.
Глава 4. Травматический шок
Современная военная доктрина предусматривает при ведении боевых действий применение новейших видов огнестрельного оружия, высокоточных средств поражения, кассетных авиационных боеприпасов объемного взрыва. Не исключается использование ядерного и биологического оружия. В связи с этим, несомненно, возрастает как частота, так и степень тяжести травматического шока. Это подтверждается данными войн и локальных военных конфликтов в различных регионах планеты, а также чрезвычайных ситуаций, возникающих в результате стихийных бедствий и экологических катастроф.
Актуальность этой проблемы связана также с тем, что еще не до конца изучены патогенетические механизмы патологических изменений, возникающих при шоке в различных органах и системах организма, а значит и оптимальные методы лечения, особенно при медицинском обеспечении боевых действий. Возникла необходимость избавиться от ряда сложившихся, но устаревших представлений и ввести в теорию и практику лечения травматического шока современную концепцию, основанную на обобщении богатого опыта ВОВ и боевых действий последних десятилетий.
В медицинской литературе термин "шок" – удар, потрясение в 1737 г. использовал французский хирург – консультант армии Людовика XV Ле Дран.
В настоящее время существует более 130 определений травматического шока, но они или очень громоздки, или не отвечают сущности патологического процесса. В военно-полевой хирургии (ВПХ) принято следующее определение: травматический шок – это критическое состояние организма, которое развивается в ответ на тяжелую механическую травму и проявляется предельным напряжением компенсаторных механизмов с последующим их истощением, прогрессирующим снижением эффективности гемодинамики и нарастающей гипоксией, вызывающей глубокие нарушения метаболизма.
Американский военный хирург Бауэрс (1953) метко заметил: "Как бы уверенно ни чувствовал себя исследователь, приступающий к подробному изучению проблемы шока, это продлится недолго. Тихое чувство оцепенения медленно овладевает им по мере того как он погрузится в поток противоречивых суждений и несогласуемых данных".
Слишком широкое толкование понятия "шок" как ответной реакции организма на самые разнообразные агрессивные воздействия следует признать неоправданным. Патогенез и клиника шокоподобных патологических состояний, именуемых геморрагическим, гемотрансфузионным, септическим, анафилактическим, кардиогенным, инсулиновым шоком и др., резко отличаются от патогенеза и клиники травматического шока.
По данным ВОВ травматический шок встречался у 8%-10% раненых, во Вьетнаме – у 20–22 %, в Афганистане – у 24–27%, в Чечне – у 25%. В зависимости от характера и локализации ранения частота развития шока может значительно меняться. Летальность при травматическом шоке в среднем достигает 40%.
К факторам, способствующим развитию шока, относятся:
1. повторное, даже незначительное, кровотечение;
2. плохая иммобилизация или ее отсутствие при переломах костей;
3. позднее и неадекватное оказание медицинской помощи;
4. травматический вынос и грубая эвакуация;
5. повторная травма при перевязках и операциях;
6. переохлаждение, перегревание, переутомление, голодание, авитаминоз, обезвоживание;
7. комбинированные поражения и наличие сопутствующих соматических заболеваний;
8. токсемия ишемического и бактериального генеза.
Патогенез травматического шока
К этиопатогенетическим факторам травматического шока относят чрезмерную афферентацию, кровопотерю, острую дыхательную недостаточность, токсемию. Недаром считается, что травматический шок – это собирательное наименование различных по этиологии и патогенезу критических состояний, наподобие термина "острый живот". Из этого следует принципиальный вывод о том, что шок – это не нозологическая форма, а один из периодов (этапов) тяжелой травматической болезни.
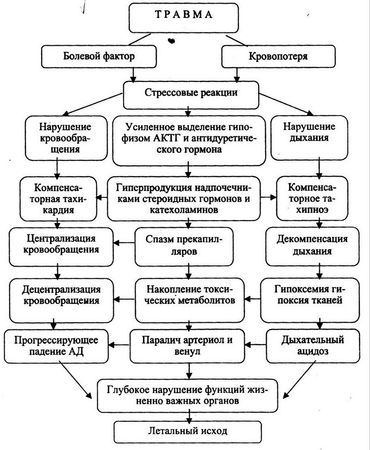
Из многочисленных теорий шока в настоящее время наибольшее распространение получила полиэтиологическая теория патогенеза травматического шока. Согласно этой теории, механизм развития шока весьма схематично представляется следующим образом. В результате тяжелой механической травмы, огнестрельного ранения, которые, как правило, сопровождаются кровопотерей и гиповолемией, возникает резкое несоответствие между объемом циркулирующей крови (ОЦК) и емкостью сосудистого русла. В нервных окончаниях поврежденной зоны возникает чрезмерная афферентная импульсация на кору головного мозга, ретикулярную формацию, подкорковые центры, гипофиз, спинной мозг, что приводит к перевозбуждению нервных клеток и выбросу в кровеносное русло целого ряда биологически активных веществ. Усиленное выделение АКТГ в свою очередь приводит к стимуляции надпочечников, вырабатывающих при этом почти в 10 раз больше нормы катехоламинов (адреналин, норадреналин). Возникает распространенный сосудистый спазм (в основном артериол и прекапиллярных сфинктеров), являющийся наиболее быстрым механизмом, обеспечивающим экстренное устранение феномена несоответствия ОЦК и емкости сосудистого русла. Катехоламины оказывают вазоконстрикторный эффект путем возбуждения альфаадренорецепторов сосудистой стенки. Общая сосудистая реакция не затрагивает лишь артерии сердца и головного мозга, так как они практически лишены альфа-адренорецепторов. Описанная сосудистая реакция имеет стратегической целью сохранение питания сердца и головного мозга ценой ухудшения (до 30–40%) перфузии других органов. Этот защитно-приспособительный механизм именуется "централизацией кровообращения".
Для компенсации гиповолемии при травматическом шоке уже через 20–30 мин включается еще один механизм – аутогемодилюция. Этот механизм основан на резком снижении гидростатического и преобладании онкотического давления в капиллярах вследствие спазма метартериол и прекапиллярных сфинктеров. В результате происходит интенсивное поступление жидкости из интерстициального пространства в сосудистое русло и через 60–80 мин замещается до 40% утраченного ОЦК.
Вследствие рефлекторного освобождения антидиуретического гормона гипофиза и альдостерона коры надпочечников резко возрастает реабсорбция солей и воды в канальцевом аппарате почек. Все эти компенсаторные механизмы в условиях шока действуют всего лишь несколько часов и при недостаточной силе приспособительных реакций и отсутствии адекватной медицинской помощи наступает стадия декомпенсации. Истощаются энергетические ресурсы ЦНС, возникает глубокое торможение нервных центров (в том числе дыхания и кровообращения). В результате нарушения микроциркуляции за счет шунтирования крови в обход капиллярного русла развиваются гипоксия тканей и ацидоз, накапливаются токсические продукты обмена веществ (гистамин, серотонин, брадикинин, молочная и пировиноградная кислоты, продукты неполного распада белков и др.). Все эти вещества, помимо токсического эффекта, обладают прямым угнетающим влиянием на кровообращение, дыхание, обменные процессы, способствуют нарушению антимикробных барьеров и формированию необратимых изменений в клетках.
Гипоксия и ацидоз приводят к утрате чувствительности рецепторов сосудистой стенки к вазопрессорам, возникают атония капилляров и внутрососудистая агрегация эритроцитов, "сладж-синдром", вследствие чего значительное количество крови задерживается в зоне микроциркуляции и венозном русле. Развивается так называемый феномен "децентрализация кровообращения", сопровождающийся грубыми нарушениями центральной гемодинамики. Снижается венозный возврат крови к сердцу, уменьшаются сердечный выброс, минутный и ударный объем.
Нарастание системных патологических изменений ведет к развитию синдрома "шок-органов" (шокового легкого, шоковой почки, шоковой печени и т. д.). Комплекс функциональных и морфологических изменений жизненно важных органов и систем приводит к "порочному кругу", из которого организм самостоятельно выйти не в состоянии. Наступает необратимый (рефрактерный) шок и переход в терминальное состояние с неизбежным летальным исходом.
Клиника и диагностика травматического шока
Традиционно травматический шок подразделяется на эректильную и торпидную фазы. Эректильная фаза. по сути, – общая адаптационная стресс-реакция организма на тяжелое механическое повреждение, длительность ее исчисляется десятками минут, и раненые в этой фазе, как правило, редко поступают на этапы медицинской эвакуации. Торпидная фаза характеризуется возникновением и быстрым нарастанием трагических патологических изменений важнейших органов и систем организма, на фоне которых разыгрывается основной и решающий в клиническом и диагностическом плане этап травматической болезни (схема 3).
Патогенетическая классификация травматического шока предусматривает деление шока на две формы: компенсированную и декомпенсированную.
Компенсированн шоком считается такой, при котором имеются все клинико-патофизиологические признаки шока, но отсутствуют признаки нарушения центральной гемодинамики. Как правило, кровопотеря не превышает в таких случаях 20% ОЦК. Декомпенсированный шок характеризуется наряду с наличием опасных для жизни тяжелых повреждений и массивной кровопотери еще и нарушениями центральной гемодинамики.
Практическое значение имеет лечение травматического шока на степени тяжести в зависимости от основных критериев: степени нарушения сознания, уровня систолическою артериального давления, частоты пульса и дыхания, а также степени тяжести и характера повреждений. В этом плане для быстрой диагностики тяжести травматического шока удобно пользоваться индексом шока "ИШ" (Алговер), который также дает ориентировочное представление о величине кровопотери. "ИШ" равен отношению частоты сердечных сокращений к уровню систолического давления. В норме он составляет 0,5–0,6.
Шок I степени.
Общее состояние средней тяжести, сознание и ориентировка сохранены, систолическое АД не ниже 90 мм рт. ст., пульс ритмичный 80–100 в 1 мин, число дыханий до 20 в 1 мин, повреждения средней тяжести, чаще изолированные, кровопотеря до 1 л, "ИШ" = 06–0,8. Наблюдается несоответствие между поведением раненого и тяжестью травмы. Симптом "несоответствия" считается основным и ведущим для диагностики травматического шока легкой и средней степени тяжести. Противошоковая терапия, даже в минимальном объеме, дает быстрый эффект. При отсутствии медицинской помощи и особенно при дополнительной травматизации раненого шок 1 степени может перейти в более тяжелую форму.
Шок II степени.
Общее состояние тяжелое, сознание сохранено, отмечается некоторая заторможенность, систолическое АД 80–90 мм рт. ст., пульс – 100–110 в 1 мин, дыхание поверхностное до 25 в 1 мин, повреждения обширные, нередко множественные или сочетанные, представляющие реальную угрозу для жизни. Кровопотеря 1–1,5 л, "ИШ" = 0,9–1,2. Прогноз серьезный, спасение жизни раненого возможно лишь при энергичном и раннем проведении комплексной противошоковой терапии.
Схема 3. Патогенез травматического шока (по П. Г. Брюсову, 1996)
Шок III степени.
Общее состояние крайне тяжелое, сознание спутанное, нередко сопорозное, систолическое давление в пределах 75–60 мм рт. ст., пульс свыше 130 в 1 мин, нитевидный, дыхание поверхностное – 30–36 в 1 мин, бледность кожи, цианоз слизистых. Повреждения обширные, множественные или сочетанные, представляющие большую угрозу для жизни уже в ближайшие минуты и часы после травмы, кро-вопотеря более 2 л, "ИШ" = 1,3–1,4. Прогноз неблагоприятный.
Достойна восхищения глубина сделанных Н. И. Пироговым наблюдений и непревзойденное по яркости описание клинической картины травматического шока. Это описание цитируется практически во всех учебниках по травматологии и военно-полевой хирургии.
Шок IV степени (терминальное состояние).
Терминальное состояние в зависимости от степени угнетения жизненных функций организма подразделяют на предагональное состояние, агональное состояние и клиническую смерть. Эти состояния являются обратимыми если они не связаны с повреждениями, не совместимыми с жизнью, и немедленные энергичные реанимационные мероприятия могут спасти жизнь раненого.
Предагональное состояние.
Характеризуется отсутствием или наличием сомнелентного сознания, систолическое давление ниже 50 мм рт. ст. или вовсе не определяется, пульс нитевидный, дыхание частое, поверхностное или периодическое типа Чейна-Стокса или Биота, резкая бледность и синюшность кожи, "ИШ" более 1,5.
Агональное состояние.
Сознание отсутствует, систолическое давление не определяется, пульс только на сонных и бедренных артериях. Дыхание редкое, судорожное, с резким максимальным вдохом и быстрым выдохом (гаспинг-дыхание) или задержкой на фазе вдоха с активным участием вспомогательной мускулатуры. Выраженный цианоз, отсутствие глазных рефлексов.
Клиническая смерть. Полное отсутствие сознания, арефлексия, пульс и тоны сердца не определяются, дыхание отсутствует, зрачки резко расширены, на свет не реагируют. Продолжительность состояния клинической смерти составляет 5–6 мин, затем наступает необратимый процесс – биологическая смерть. Если удалось предотвратить летальный исход в первые часы развития травматической болезни, то развивается сложный патологический динамический процесс со сменяющими друг друга периодами травматической болезни. Эти периоды не имеют четких временных границ, но соответствующая им смена ведущих клинических проявлений имеет прямую связь с ключевыми патогенетическими механизмами. Осложнения, свойственные каждому периоду, носят не абсолютный, а вероятностный характер, но их необходимо учитывать, чтобы правильно определить тактику лечения.
I период травматической болезни – период шока, длительность которого составляет 12–48 ч. В этот период причинами критических ситуаций и смерти раненых являются несовместимые с жизнью повреждения внутренних органов и острая массивная кровопотеря.
II период – период полиорганной недостаточности, характеризуется развитием патологических изменений в различных органах и системах организма.
Дыхательная система.
Нарастает дыхательная недостаточность по типу респираторного дистресс-синдрома. Расстройство легочного газообмена при этом происходит за счет изменения оптимального соотношения вентиляции и кровотока, а также вследствие шунтирования венозной крови в легких, нарушения инактивации и синтеза сурфактанта, что приводит к интерстициальному отеку легких и развитию "шокового легкого".
Сердечно-сосудистая система.
Сердечно-сосудистая недостаточность проявляется в виде острой кардиомиодистрофии, сопровождающейся грубыми нарушениями центральной гемодинамики, расстройствами коронарного кровотока и сердечной проводимости.
Ранний травматический эндотоксикоз – неизменный спутник травматической болезни. Эндогенная интоксикация вызывается продуктами разрушения и аутолиза тканей, вазоактивными субстанциями, продуктами извращенного катаболизма белков, бактериальными токсинами вследствие нарушения барьерной функции организма. Патогенетическое действие этих факторов в полной мере проявляется спустя 48–72 ч после повреждения.
Почечно-печеночная недостаточность при травматической болезни наблюдается в 6–8% случаев и является следствием синдрома "шоковой почки", "шоковой печени". Развитию этого синдрома способствуют длительная первичная гипотензия, микроциркуляторные нарушения с возникновением глубокой системной и органной гипоксии, а также выраженная эндогенная интоксикация.
Коагулопатические расстройства крови.
Тяжелая механическая травма, сопровождающаяся развитием травматического шока, вызывает грубую диссоциацию узловых составляющих механизмов системной регуляции агрегатного состояния крови (PACK), при этом развивается высшая форма коагуляционных расстройств – тромбогеморрагический сидром или синдром диссеминированного внутрисосудистого свертывания (ДВС), характеризующийся вначале тотальным внутрисосудистым тромбозом, затем – тотальным фибринолизом и несвертыванием крови. Коагулопатические расстройства крови – одна из причин развития синдрома "шок-органов".
Жировая эмболия встречается в 3–5% случаев и наблюдается чаще всего при переломах костей, массивных повреждениях мягких тканей, множественных и сочетанных повреждениях, особенно при нарушении правил иммобилизации и транспортировки раненых.